Основные понятия и определения
53 (075.8)
М 348
министерство энергетики И УГОЛЬНОЙ
ПРОМЫШЛЕННОСТИ украины
СЕВАСТОПОЛЬСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
ЯДЕРНОЙ ЭНЕРГИИ И ПРОМЫШЛЕННОСТИ
Ф и з и к а

Курс лекций
Ч а с т ь 2
Под редакцией О.В. Матузаевой
У т в е р ж д е н о
Ученым советом университета
Севастополь
2012
53 (075.8)
М 348
УДК 53 (075.8)
Авторский коллектив: Гарматенко Т.И., Матузаева О.В.,
Марончук И.И., Довгаленко В.В.
М 348 Физика:учеб. пособие. – Ч. 2. – Севастополь: СНУЯЭиП, 2012. - 244 с.: ил.
Написано в соответствии с учебной программой по курсу физики для студентов СНУЯЭиП. Рекомендуется в качестве дополнительного пособия студентам очной и слушателям заочной формы обучения при изучении курса общей физики.
Часть 2 содержит лекции по темам: «Молекулярная физика и термодинамика», «Колебания и волновая оптика», «Квантовая механика и физика твёрдого тела».
Рецензенты: д.т.н., профессор И.Е. Марончук
к.ф.-м.н, доцент С.А. Чернявская
доцент И.Б. Стаценко
Литературный редактор Р.В. Дмитриева
Технический редактор Н.Н. остапенко

Подписано к печати 26.03.12. Изд. № 16/12. Зак. 423/2012. Тираж 200 экз.
Объем 15,25 п. л. Усл. печ. л. 14,18. Уч.-изд. л. 14,945.
Формат бумаги 60 х 84 1/16
 |
Издательский центр СНУЯЭиП
© Издание СНУЯЭиП, 2012
Лекция 1

ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
|
|
|
Предмет и метод молекулярно-кинетической теории
Изучения физических явлений
Молекулярная физика– это раздел физики, изучающий строение и свойства вещества, исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Представления о молекулярном строении вещества зародились еще в глубокой древности. Древнегреческие философы Анаксагор и Демокрит считали, что все вещества состоят из мельчайших неделимых частиц – атомов. Эти идеи в различной форме высказывались и развивались многими исследователями на протяжении веков. Существенный прогресс молекулярно-кинетическая теория получила в трудах М.В. Ломоносова (1711-1765 гг.). На основе этой теории Ломоносов впервые объяснил тепловые явления как результат движения атомов и молекул вещества, предсказал существование абсолютного нуля температуры и доказал справедливость представления о непрерывном тепловом движении атомов и молекул.
Во второй половине XIX века и в начале XX века молекулярная теория получила строго научное развитие благодаря трудам Клаузиуса (1822 -1888), Максвелла (1831 - 1879) и Больцмана (1844 - 1906).
|
|
|
В настоящее время молекулярно-кинетическая теория вещества признана, проверена и подтверждена тысячами экспериментов и новыми данными науки.
При рассмотрении основных идей и закономерностей современной молекулярно-кинетической теории вещества исходят из следующих основных положений.
1. Все тела в природе состоят из атомов и молекул. Молекула – это наименьшая частица вещества, сохраняющая все его свойства (атом можно рассматривать как одноатомные молекулы).
Доказательство: наблюдение строения вещества в электронный микроскоп и рентгеноструктурный анализ.
2. Молекулы находятся на некотором расстоянии друг от друга, что подтверждается возможностью изменять форму, объем тел под действием внешних сил.
3. Между молекулами вещества действуют как силы отталкивания, так и силы притяжения, что подтверждается необходимостью воздействовать на тело внешними силами, как при сжатии, так и при растяжении.
4. Молекулы вещества находятся в непрерывном хаотическом движении, что подтверждается наблюдениями броуновского движения и явлением диффузии. С повышением температуры скорости движения молекул увеличиваются, т.е. их кинетическая энергия связана с температурой. Поэтому хаотическое движение молекул называется тепловым.
|
|
|
5. Все направления хаотического движения молекул равновероятны.
6. В любом объеме число молекул велико.
Молекулярно-кинетическая теория объясняет макроскопические свойства тел путем анализа молекулярных процессов лежащих в их основе. Так давление газа обусловлено ударами молекул о стенки сосуда. Измеряя давление наблюдается средний эффект ударов огромного числа молекул за сравнительно большой промежуток времени по сравнению со временем удара молекулы о стенку сосуда.
Беспорядочность движения молекул подчиняется определенным статистическим закономерностям. Метод, применяемый для определения макроскопических свойств тел с точки зрения их молекулярного строения, получил название статистического. В основе статистического метода лежит математический аппарат теории вероятности. Статистический метод позволяет определить макроскопические величины как средние значения огромного числа отдельных элементарных процессов.
основные понятия и определения
Для количественного и качественного объяснения процессов, происходящих в веществе с точки зрения его молекулярного строения, введем основные понятия и определения.
|
|
|
1. Количество вещества измеряется в молях. Моль – это количество вещества, в котором содержится столько же структурных элементов (атомов, молекул, ядер), сколько содержится атомов в изотопе углерода –  массой 0,012 кг.
массой 0,012 кг.
Моль отнесен к числу основных единиц измерения. [n] = 1моль.
2. Из определения моля следует, что моли различных веществ в различном агрегатном состоянии содержат одинаковое число структурных элементов. Это число, содержащее одинаковое число структурных элементов, называется числом Авогадро
 моль-1. Число Авогадро – это число атомов (молекул и других структурных элементов), содержащихся в 1 моле различных веществ.
моль-1. Число Авогадро – это число атомов (молекул и других структурных элементов), содержащихся в 1 моле различных веществ.
3. Число молекул ( N ) в данной массе ( m ) вещества:
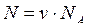 .
.
4. Молярная масса (m ) – это физическая величина, численно равная массе одного моля вещества:
 кг/моль,
кг/моль,  - число молей,
- число молей,
где m – масса вещества, v – число молей, которое содержится в данной массе m.
5. Масса одной молекулы:
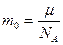 кг.
кг.
( 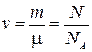 , учитывая, что
, учитывая, что 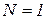 получим формулу для определения массы молекулы.)
получим формулу для определения массы молекулы.)
6. Концентрация молекул – это физическая величина численно равная числу молекул в единице объема.
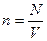 м-3.
м-3.
7. Плотность вещества – это физическая величина численно равная массе одного кубического метра вещества.
 ,
,
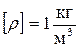 .
.
8. Молярный объем – это физическая величина численно равная объему однородной системы одного моля вещества.
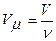 ,
,

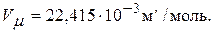
9. Атомная единица массы (а.е.м.)  массы покоя атома углерода –12 (
массы покоя атома углерода –12 ( 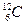 ).
).
1а.е.м.= 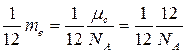
1а.е.м.=  кг.
кг.
Основные параметры
Все тела имеют определенные характеристики: объем, плотность, температуру и т.д., называемые параметрами тела.
Тело может находиться в различных состояниях, характеризующихся определенными параметрами. Переход тела из одного состояния в другое, сопровождающийся изменением параметров, называется процессом.
Любое состояние газа характеризуется, прежде всего, следующими параметрами:
- давлением;
- объемом;
- температурой.
а) Давление (р) – это параметр состояния, определяемый силой, действующей на единицу площади поверхности по нормали.
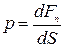 ,
,
где  - проекция силы на нормаль к элементу поверхности
- проекция силы на нормаль к элементу поверхности 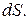
Если давление одинаково на всей поверхности 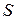 , то
, то
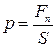 ,
,  .
.
1 Па – это такое давление при котором на каждый квадратный метр действует сила в 1 Н.
Следует учесть, что: 1 мм рт. ст. = 133,3 Па; 1 атм = 105 Па.
б) Объемом (V)газа называется объем межмолекулярного пространства в сосуде, содержащем газ.
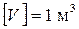 .
.
в) Температура (Т) – это параметр, характеризующий тепловое состояние системы и служит мерой интенсивности теплового движения атомов, молекул и других частиц, образующих систему.
В Международной системе измерения (СИ) установлена термодинамическая температурная шкала, в которой температура измеряется в кельвинах (К).
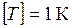 .
.
Связь между абсолютной температурой и температурой (t) по шкале Цельсия: 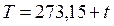 .
.
Следует отметить, что: 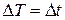 .
.
Температура 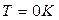 (по шкале Цельсия
(по шкале Цельсия 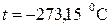 ) называется абсолютным нулем температуры.
) называется абсолютным нулем температуры.
Нормальные условия: 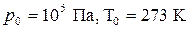 .
.
Дата добавления: 2019-09-13; просмотров: 160; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
