A Tandem Amino-Cope Rearrangement/Enamine Alkylation Reaction
Экспериментальная часть.
Синтез (3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)метилкетона I I:
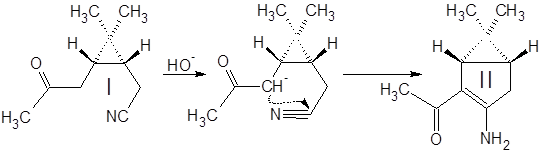
К 350 мл спиртового раствора KOH при перемешивании в течение 10 мин. добавили 100 г кетонитрила I. Смесь нагрели и кипятили с обратным холодильником 15 мин., охладили и разбавили водой в три раза. Провели экстракцию смеси метилтретбутиловым эфиром (300, 300, 150 мл), эфирную фазу экстрагировали 1М HCl (900, 500, 300 мл). Полученный водный раствор нейтрализовали 30% аммиаком и экстрагировали tBuOMe (200, 200, 100 мл). Эфирный раствор высушили MgSO4 безв и отогнали растворитель. Выход 79%.
Синтез ( 3-амино-2-бензил-6,6-диметилбицикло[3.1.0]гекс-2-ил)метилкетона III:
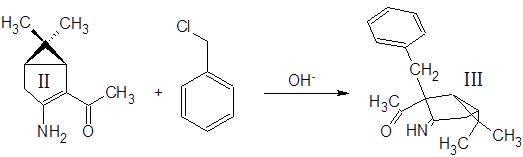
5 г енаминокетона II растворили в 30 мл бензола, в раствор добавили 15 мл 40% водного раствора NaOH и 0.5 г Bu4N+NO-3, перемешивали несколько минут и постепенно (3 мин.) добавили 10 мл бензилхлорида. Смесь интенсивно перемешивали 1.5 часа при 35-40˚С. Водную фазу отбросили, органическую экстрагировали 1М H2SO4 (15, 15, 15 мл). Экстракт нейтрализовали избытком 30% аммиака и экстрагировали метилтретбутиловым эфиром. Эфирный раствор высушили MgSO4 безв и отогнали растворитель. Выход 44%.
Синтез 1-(3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)этанола:
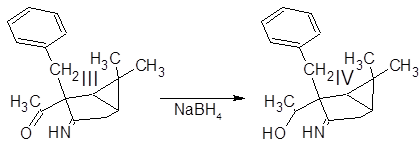
4 г алкилированого енаминокетона III растворили в 40 мл этанола. В раствор всыпали 0.6 г NaBH4 и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавили водой и экстрагировали эфиром. Эфирную фазу промыли водой для удаления спирта и вылили в водный раствор 4 г Cu(OAc)2·2H2O. Голубые кристаллы отфильтровали и высушили на воздухе.
Продукты исследовали методами хроматомасс-спектрометрии, ИК и ЯМР 13C и 1H. ЯМР спектры регистрировали на приборе Bruker DPX-500 (НИОХ СО РАН) в смеси CCl4/CDCl3; химсдвиги отсчитывали: в протонных спектрах – от сигнала остаточных протонов CDCl3 (7.250 м.д.), в спектрах 13С – от сигнала атома углерода CCl4 (96.10 м.д.). ИК спектры записывали на однолучевом спектрометре Bruker Vector 22 (256 усреднений с вычетом фона). Хроматомасс-спектрометрический анализ выполнен сотрудниками НИОХ.
Бензилхлорид и все растворители использовали свежеперегнанными. Точность отсчета температуры ±2°С, времени – ±2 мин. Тонкослойная хроматография выполнена на пластинках “Silufol”® (SiO2 на алюминиевой фольге).
Результаты и их обсуждение.
Из описанных выше реакций С-алкилирования наилучшим образом изучены реакции алкилирования b-дикетонов и енаминов. По енаминокетонам, несмотря на их широкое применение в синтезе, данных значительно меньше. Практическая потребность в проведении алкилирования и обнаруженная неоднозначность протекания этой реакции потребовали ее более детального изучения на конкретных соединениях. В качестве алкилирующего реагента был избран бензилхлорид, в условиях реакции не дающий продуктов полиалкилирования (метилирование в тех же условиях может быть четырех-пятикратным [14]).
Схема проведенных превращений такова:
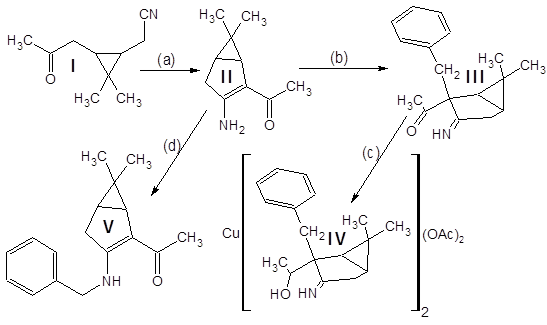
Кетонитрил I (исходное соединение, чистота ~90% (ГЖХ), предоставлен ЛТС НИОХ СО РАН) является производным природного терпена – 3-карена, выделяемого из соснового скипидара:

Результирующее соединение IV используется далее в синтезе оптически активных комплексных соединений, используемых в асимметрическом катализе.
Кетонитрил I представляет собой вязкую темную жидкость, растворимую в органических растворителях и нерастворимую в воде. Реакция (а) проходит гладко и с высоким выходом (~80%) дает продукт конденсации – (3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)метилкетон II.
Отдельного рассмотрения заслуживает процесс бензилирования соединения II. Эта реакция при комнатной температуре протекает крайне неоднозначно, с выходом целевого продукта менее 10% и образованием трудноразделимой смеси изомерных продуктов и продуктов полиалкилирования. Схема превращений и идентифицированные продукты представлены на следующем рисунке:
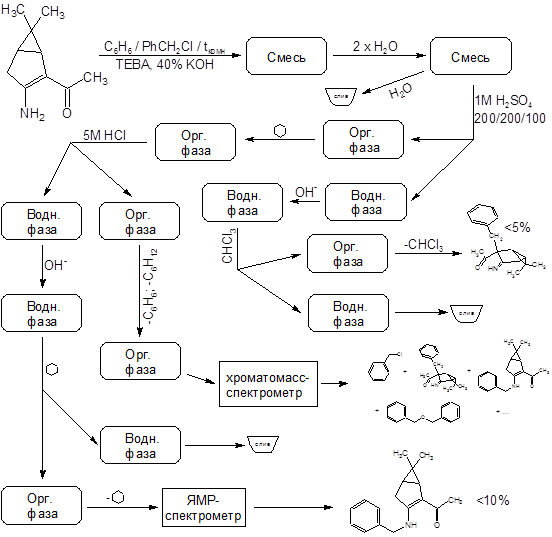
Показанные на схеме процессы обладают повторяемостью – по данным тонкослойной хроматографии в продуктах нескольких проведенных реакций набор компонентов один и тот же. Выходы выделенных веществ тоже примерно одинаковы. Спектры ядерного магнитного резонанса N-алкилированого продукта имеются в Приложениях. Его выход составляет 10%, но (!) – зимой. В тех же реакциях, осуществленных летом, продукт N-алкилирования зафиксирован не был.
Предположение о связи направления алкилирования с температурой реакционной смеси (а в методике указана комнатная температура) подтвердилось – проведение реакции при 35ºС дало в качестве преобладающего продукта (с выходом ~60%) целевой С-замещенный енаминокетон, алкилирование прошло так, как описано в “летней” методике. Попытки дальнейшего повышения температуры пока не предпринимались.
Полученный (3-амино-2-бензил-6,6-диметилбицикло[3.1.0]гекс-2-ил)метилкетон III был введен в реакцию с избытком боргидрида натрия для восстановлния карбонильной группы в спиртовую.
Точный состав и строение комплекса IV неизвестны – парамагнитный ион меди II препятствует получению спектров ЯМР, по данным ИК-спектра что-либо определенное сказать затруднительно. Сводка полученных характеристик соединений дана ниже:
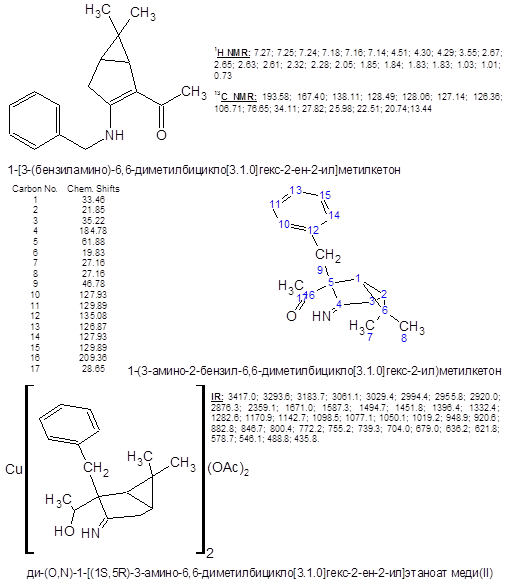
Результаты проделанной работы можно суммировать следующим образом:
- синтезированы и охарактеризованы спектрально и хроматографически некоторые производные природного терпена 3-карена.
- обнаружена значительная зависимость хода реакции бензилирования (3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)метилкетона от температуры реакционной смеси. Установлено, что оптимальный выход С-бензилированного производного достигается при t≥35˚C.
- установлен тот факт, что “комнатная” температура – весьма ненадежная характеристика методики синтеза.

Литература.
1. S. Dyke // Chemistry of enamines. // Cambridge University Press, Cambridge, 1973.
2. A. Cook (ed) // Enamines: synthesis, structure and reactions. // Marcell Decker, New York, 1969.
3. I. Chaaban, J. Greenhill, M. Ramli // Reactions between enaminones and enones. Part 2. C versus N-alkylation with cyclohex-2-enone. Structure confirmation by reduction of a dienaminone derivative of a dehydrated dimedone dimer. // J. Chem. Soc. Perkin Trans., 1981, 1, 3120-3124.
4. J. Whitesell, M. Whitesell // Alkylation of ketones and aldehydes via their nitrogen derivatives. // Synthesis, 1983, 7, 517-536.
5. A. Zanina, S. Shergina, I. Sokolov, M. Shvartsberg // Alkylation of sterically hindered 1,3-diketones under phase-transfer conditions. // Russ. Chem. Bl., 1996, 45, 2389-2392 // Izv. Akad. Nauk Ser. Khim. 1996, 10, 2518-2521.
6. S. Lu, A. Lewin // Enamine-imine tautomerism in α,β-unsaturated α-amino acids. // Tetrahedron, 1998, 54, 15097-15014.
7. J. Henriksen, S. Hammerum // Heats of formation of imine and enamine radical cations and the corresponding neutral molecules // Int. J. Mass Spect, 1998 179/180, 301-308.
8. S. Caccamese, G Principato // Resolution of the enantiomers of tetrahydrozoline by chiral HPLC. The racemization of the enantiomers via an imine-enamine tautomerism. // Tetrahedron: Asymmetry, 1998, 9, 2939-2945.
9. M. Shimizu, A. Morita, T. Kaga // Double nucleophilic addition to α,β-unsaturated aldimines induced by titanium tetrahalides. // Tetrahedron Lett., 1999, 40, 8401-8405.
10. S. Knüppel, R. Frölich, G. Erker // Formation of functionalized [3]ferrocenophane derivatives by an enamine condensation reaction.// J. Organomet. Chem., 2000, 595, 308-312.
11. A. Tkachev, A. Rukavishnikov // Enaminones of the 2-acetylcyclopent-1-en-1-ylamine type derived from the terpenic compounds limonene, 3-carene and δ-cadinol. // Mendeleev Commun., 1992, 1, 161-162.
12. S. Popov, A. Tkachev // New chiral agents for resolution of racemic cis-permethric and cis-Z-cyhalothric acids. // Tetrahedron: Asymmetry, 1995, 6, 4, 1013-1018.
13. J. Greenhill, A. Moten // N-Alkylation of enaminones. // Tetrahedron, 1983, 39, 3405-3408.
14. A. Tkachev, S. Popov // Alkylation of enaminoketone with a modified carane skeleton. Formation of stable β-diketone monoimines. // Russ. J. Org. Chem., 1997, 33, 5, 601-606.
15. T. Tiner-Harding, P. Mariano // Intramolecular photoarylations of N-(haloaryl)ethyl-β-enaminones. // J. Org. Chem., 1982, 47, 482-485.
16. P. Bugler, I. Cottrell, C. Cowden, A. Davies, U. Dolling // An investigation into the alkylation of 1,2,4-triazole // Tetrahedron Lett., 2000, 41, 1297-1301.
Приложение 1 .
Данные и аннотации некоторых статей ( Belstein Abstracts).
Alkylation of Enaminoketone with a Modified Carane Skeleton. Formation of Stable b-Diketone Monoimines
A. V. Tkachev; S. A. Popov
Source details: Russ.J.Org.Chem. 1997, 33 : 5 601-606.
Document type: Journal
CODEN: RJOCEQ
Language: EN
CNR: 6090629
Original Source: Zh.Org.Khim. 1997, 33 : 5 660-665.
CODEN: ZORKAE
Language: RU
Abstract
Alkylation of a bicyclic enaminoketone, 1-((1R,5R)-3-amino-6,6-dimethylbicyclo[3.1.0]hex-2-en-2-yl))ethanone, with highly reactive alkyl halides (methyl iodide, benzyl halides, and allyl halides) in a two-phase system benzene-40% aqueous NaOH in the presence of benzyltriethylammonium chloride (BTEA) as phase-transfer catalyst results in formation of stable b-diketone monoimines, derivatives of the series of 1-((1R,5R)-2-alkyl-3-imino-6,6-dimethylbicyclo[3.1.0]hex-2-yl)ethanone, in 53-81% yields.
Alkylation of sterically hindered 1,3-diketones under phase-transfer conditions
A. S. Zanina; S. I. Shergina; I. E. Sokolov; M. S. Shvartsberg
Source details: Russ.Chem.Bl. 1996, 45 : 10 2389-2392.
Document type: Journal
CODEN: RCBUEY
Language: EN
CNR: 6056087
Original Source: Izv.Akad.Nauk Ser.Khim. 1996, 10 2518-2521.
CODEN: IASKEA
Language: RU
Abstract
Sterically hindered 1,3-diketones react selectively with propargyl and allyl bromides under conditions of phase transfer catalysis to give C-alkylated products, whereas reactions with butyl and benzyl chlorides yield mixtures of C- and O-isomers.An increase in the size of the substituents present in the initial 1,3-diketone hampers introduction of the second propargyl group.The propargyl-substituted 1,3-diketones undergo cyclization under the alkylation conditions to give substituted furans.
Sequence of alkylation of cyclohexane-1,3-dione. Alternative synthesis of (+/-)-angustione
A. A. Zenyuk; L. G. Lis; L. I. Ukhova
Source details: Chem.Nat.Compd.(Engl.Transl.) 1991, 27 : 4 400-403.
Document type: Journal
CODEN: CHNCA8
Language: EN
CNR: 5645800
Original Source: Khim.Prir.Soedin. 1991, 4 460-463.
CODEN: KPSUAR
Language: RU
Abstract
A method is proposed for introducing one, two, or three alkyl substituents into positions 4 and 6 of the cyclohexane-1,3-dione molecule by successive alkylation under the action of strong bases. (+/-)-Angustione (a natural -diketone) has been synthesized.
A Tandem Amino-Cope Rearrangement/Enamine Alkylation Reaction
Дата добавления: 2019-07-15; просмотров: 53; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
