Тема: «Свойства соединений хрома. Свойства соединений марганца»
Цель работы: экспериментально изучить некоторые свойства соединений хрома и марганца.
Опыт № 1. Окислительные свойства дихроматов
В пробирку поместите раствор дихромата калия и добавьте раствора серной кислоты и раствора калия йодида. Отметьте наблюдения. Определите тип данной реакции. Cоставьте электронный баланс:
K2Cr2O7 + H2SO4 + KJ → J2 + Cr2(SO4)3 + K2SO4 + H2O
Сделайте вывод.
Опыт № 2. Перевод хроматов в дихроматы и наоборот
В пробирку поместите раствор хромата калия и добавьте разбавленную серную кислоту. Как изменилась окраска? К полученному раствору добавьте
раствор щелочи. Отметьте наблюдения и допишите уравнения реакций:
K2CrO4 + H2SO4 →
K2Cr2O7 + NaOH →
Сделайте вывод.
Опыт № 3. Окислительные свойства перманганата калия
В три пробирки налейте раствор перманганата калия. В одну пробирку добавьте концентрированную серную кислоту, в другую – концентрированный раствор щелочи, а в третью – воду очищенную. Затем во все пробирки добавьте раствор сульфита натрия. Отметьте наблюдения и допишите уравнения реакций:
KMnO4 + Na2SO3 + H2SO4 →
KMnO4 + Na2SO3 + NaOH →
KMnO4 + Na2SO3 + H2O →
Составьте электронный баланс для одной из реакций.
Сделайте вывод.
Оснащение: реактивы — раствор дихромата калия, раствор хромата калия, раствор серной кислоты, раствор калия йодида, раствор щелочи, раствор сульфата марганца, раствор перманганата калия, раствор сульфита натрия, вода очищенная.
|
|
|
Оборудование — пробирки, глазные пипетки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Свойства соединений железа»
Цель работы: экспериментально изучить некоторые свойства соединений железа (II) и (III). Освоить технику проведения качественных реакций на ионы железа (II) и ион железа (III).
Опыт № 1. Получение гидроксида железа ( II ) и изучение его свойств
В пробирку поместите свежеприготовленный раствор сульфата железа (II) и добавьте раствор щелочи. Отметьте наблюдения и допишите уравнение реакции:
FeSO4 + NaOH →
Обратите внимание на изменения, происходящие с гидроксидом железа (II) на воздухе. Допишите уравнение реакции:
Fe(OH)2 + O2 + H2O →
Сделайте вывод.
Опыт № 2. Качественная реакция на ион железа ( II )
В пробирку поместите раствор сульфата железа (II) и добавьте раствор красной кровяной соли K3[Fe(CN)6]. Отметьте наблюдения и допишите уравнение реакции:
FeSO4 + K3[Fe(CN)6] →
Сделайте вывод.
Опыт № 3. Качественная реакция на ион железа ( III )
3.1. В пробирку поместите раствор хлорида железа (III) и добавьте раствор роданида калия. Отметьте наблюдения и допишите уравнение реакции:
FeCI3 + KCNS →
Сделайте вывод.
3.2. В пробирку поместите раствор хлорида железа (III) и добавьте раствор жёлтой кровяной соли K4[Fe(CN)6]. Отметьте наблюдения и допишите уравнение реакции:
|
|
|
FeCI3 + K4[Fe(CN)6] →
Сделайте вывод.
Оснащение: реактивы — раствор роданида калия, раствор сульфата железа (II), раствор щелочи, раствор красной кровяной соли K3[Fe(CN)6], раствор хлорида железа (III), раствор жёлтой кровяной соли K4[Fe(CN)6].
Оборудование — пробирки, глазные пипетки.
РАЗДЕЛ 2. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ОРГАНИЧЕСКОЙ ХИМИИ
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Углеводороды»
Цель работы: изучить способы получения и свойства углеводородов.
Опыт № 1. Изучение свойств алканов
На предметное стекло нанесите на некотором расстоянии друг от друга по 1 капле раствора калия перманганата, бромной воды и серной кислоты. Смешайте каждую из них с одной каплей вазелинового масла. Допишите схемы реакций:
Вазелиновое масло + КМnO4 →
Вазелиновое масло + Br2 →
Вазелиновое масло + H2SO4 →
Вазелиновое масло - предельный углеводород не обесцвечивает бромную воду. Можно ли из этого сделать вывод, что предельные углеводороды не взаимодействуют с галогенами?
Сделайте вывод о реакционной способности алканов.
Опыт № 2. Горение парафина
В фарфоровую чашку поместите кусочек парафина и поднесите к нему зажженную лучинку. Горение не наблюдается. Подогрейте парафин – он плавится, закипает. Поднесите зажженную лучинку, пока парафин не загорится большим коптящим пламенем.
|
|
|
Допишите уравнение реакции и сделайте вывод.
С18Н38 + О2 →
Опыт № 3. Горение полиэтилена
Кусочек полиэтилена внесите щипцами в пламя горелки. Он горит синим пламенем без копоти. Для прекращения горения образец опустите в воду. Допишите уравнение химической реакции:
(-СН2-СН2-)n + О2 →
Отметьте наблюдения. Сделайте вывод.
Опыт № 3. Отношение полиэтилена к окислителям
В одну пробирку налейте 1 мл раствора перманганата калия, в другую столько же раствора перекиси водорода и погрузите в них несколько кусочков полиэтилена. Отметьте наблюдения. Допишите схемы реакций:
(-СН2-СН2-)n + KMnO4 →
(-СН2-СН2-)n + H2O2→
Сделайте вывод.
Опыт № 4. Получение ацетилена и изучение его свойств
В три пробирки поместите карбид кальция, добавьте по 4 капли воды, затем добавьте в одну из них несколько капель раствора калия перманганата, в другую - бромную воду, в третью - аммиачный раствор нитрата серебра. Отметьте наблюдения. Допишите уравнения реакций получения ацетилена и его взаимодействия с выше указанными реактивами:
|
|
|
СаС2 + Н2О2 →
С2Н2 + КМnO4→
С2Н2 + Br2→
С2Н2 + [Ag(NH3)2]OH→
Сделайте вывод.
Опыт № 5. Действие бензола на бромную и иодную воду
Налейте в одну пробирку 5 капель бромной воды, в другую 5 капель иодной
воды. Добавьте в каждую по 2 капли бензола и хорошо встряхните. Допишите схемы реакций:
С6Н6 + Br2 →
C6H6 + I2 →
Наблюдаются ли признаки реакции?
Сделайте вывод, почему окраска брома и йода не исчезает.
Опыт № 6. Бромирование гомологов бензола
В пробирку налейте 5 капель толуола и добавьте 2 капли бромной воды. Реакция протекает не сразу, нужно встряхнуть и немного подождать. Можно слегка нагреть. Добейтесь обесцвечивания бромной воды. Отметьте наблюдения. Допишите уравнение реакции:

+Br2→
Сделайте вывод. Почему гомологи бензола легче вступают в реакцию замещения?
Опыт № 7. Окисление аренов
 Приготовьте в двух пробирках смесь растворов, состоящую из 5 капель перманганата калия и 5 капель раствора серной кислоты. В одну пробирку добавьте каплю бензола, в другую толуола. Осторожно нагрейте, встряхните. Отметьте наблюдения. Допишите уравнения реакций:
Приготовьте в двух пробирках смесь растворов, состоящую из 5 капель перманганата калия и 5 капель раствора серной кислоты. В одну пробирку добавьте каплю бензола, в другую толуола. Осторожно нагрейте, встряхните. Отметьте наблюдения. Допишите уравнения реакций:
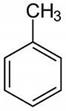 +[О]→
+[О]→
+[О]→
Сделайте вывод. Почему толуол окисляется, а бензол нет?
Опыт № 8. Синтез хлороформа
В пробирку поместите 3-4 кристалла хлоралгидрата, 6-8 капель раствора щелочи и слегка подогрейте. Сразу же начинается выделение хлороформа. Обратите внимание на его характерный запах. Отметьте наблюдения. Допишите уравнение реакции:
CCl3CH(OH)2 + NaOH →
Сделайте вывод.
Оснащение: реактив — концентрированная серная кислота, раствор калия перманганата, бромная вода, карбид кальция, раствор щёлочи, кристаллы хлоралгидрата, вода очищенная, аммиачный раствор оксида серебра, полиэтилен; вазелиновое масло, парафин, бензол, толуол.
Оборудование — спиртовки, спички, стеклянные палочки, предметные стекла, стеклянные палочки, лучинки, фарфоровые чашки, пробирки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Альдегиды. Кетоны»
Цель работы: приобрести умение осуществлять экспериментально и объяснять сущность качественных реакций на альдегидную группу
Опыт № 1. Окисление альдегидов
1.1. Реакция «серебряного зеркала»:
Поместите в пробирку 5 капель раствора нитрата серебра и 5 капель раствора аммиака. Добавьте 3-5 капель раствора формалина и подогрейте полученную смесь над пламенем спиртовки. Отметьте наблюдения. Допишите уравнение реакции:
НСООН + [Ag(NH3)2]OH 
1.2. Реакция «медного зеркала»:
Поместите в пробирку 5 капель раствора сульфата меди и 5 капель раствора щёлочи. Добавьте 3-5 капель раствора формалина и подогрейте полученную смесь над пламенем спиртовки. Отметьте наблюдения. Допишите уравнения реакций:
CuSO4 + NaOH →
HCOH + Cu(OH)2 
Сделай вывод.
Опыт № 2. Реакции окисления формальдегида
Поместите в пробирку 2-3 капли 40%-го раствора формальдегида. Добавьте 1 каплю индикатора метилового красного, раствор краснеет.
Сделайте вывод.
Опыт № 3. Синтез уротропина
На предметное стекло поместите 1 каплю 1% раствора фенолфталеина, добавьте 2 капли раствора аммиака. Обратите внимание на цвет раствора. Затем добавьте 1 каплю формалина до обесцвечивания раствора. Опять добавьте 2 капли раствора аммиака, вновь раствор розовеет. Несколько капель раствора поместите на предметное стекло и выпарите над пламенем спиртовки. На стекле остались кристаллики уротропина.
Допишите уравнение реакции:
HCOH + NH3 →
Чем объяснить дезинфицирующее свойство уротропина? Сделайте вывод.
Опыт № 4. Йодоформная проба
Поместите в пробирку 1 каплю водного раствора йода в иодиде калия и до обесцвечивания раствор щелочи. К обесцвеченному раствору добавьте 1 каплю водного раствора ацетона. Наблюдения?
Допишите уравнения реакций:

Эта реакция позволяет открыть ацетон при его содержании до 0,04%.
Оснащение: реактивы — формалин, аммиачный раствор оксида серебра, раствор сульфата меди (II), раствор шелочи, раствор белка, фенолфталеин, раствор аммиака, раствор йода в иодиде калия, водный раствор ацетона; метиловый красный.
Оборудование - пробирки, спиртовки, спички, предметные стекла, пипетки.
ПРАКТИЧЕСКАЯ РАБОТА
Дата добавления: 2019-02-22; просмотров: 506; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
