Расчёты с применением изотонических эквивалентов по натрию хлориду
Для определения изотонических концентраций растворов различных веществ расчеты проводят, в основном, тремя методами :
1. Исходя из закона Вант– Гоффа и уравнения Менделеева– Клапейрона;
2. Криоскопическим методом ( с использованием закона Рауля);
3. С применением изотонических эквивалентов лекарственных веществ по натрию хлориду.
Метод расчёта изотонической концентрации, основанный на использовании закона Вант–Гоффа и уравнения
Менделеева– Клапейрона
По закону Вант–Гоффа растворённые вещества в разбавленных растворах неэлектролитов ведут себя аналогично газам, и поэтому к ним с достаточным приближением применимы газовые законы. Осмотическое давление разбавленных растворов подчиняется закону, установленному для давления газов.
Фактор изотонии можно вывести из уравнения Менделеева–Клапейрона:
PV= nRT где,
P– осмотическое давление плазмы крови, в атмосферах;
V– объём раствора, в л;
n– число грамм– молекул растворённого вещества;
R– газовая постоянная 0,082 атмл;
T– абсолютная температура газа в К°=3100.
Из формулы:
n= PVRT= 7,4 ´ 10,082 ´ 310= 0,29 г моль л
Следовательно, чтобы приготовить изотонический раствор любого неэлектролита следует взять 0,29 г моль вещества на один литр раствора, т.е.
m = 0,29 М, где:
m– количество вещества в граммах, необходимое для приготовления одного литра изотонического раствора;
M– молярная масса лекарственного вещества.
При расчёте изотонических концентраций электролитов в уравнение вводят поправочный множитель i, называемый изотоническим коэффициентом Вант– Гоффа. Тогда m=0,29М/i.
Величина изотонического коэффициента выражается уравнением:
i = 1+ a ( n– 1), где:
a– степень электролитической диссоциации;
n– число ионов, на которое диссоциирует одна молекула вещества.
Для неэлектролитов, например, глюкозы i= 1.
Для электролитов величина i зависит от природы вещества, степени электролитической диссоциации и количества образующихся ионов.
Для различных групп электролитов коэффициент i может быть рассчитан. Например, для бинарных электролитов с однозарядными ионами типа К+А– (a= 0,86, n = 2), i = 1+ 0,86(2–1)=1,86.
Пример. Рассчитать количество NaCl, для изготовления 1 л изотонического раствора. m =0,29´58,51,86 = 9,12 г на 1 литр.
Для бинарных двузарядных К2+А2-( МgSO4, ZnSO4, FeSO4 и др.) n =2,
i= 1,5, a= 0,5.
Для тринарных К2+А1 (СаСl2 ), К1+А2- (Na2 SO4, Na 2CO 3) n=3, i= 2,5,
a= 0,75.
Для слабых электролитов (кислота борная, лимонная) i = 1,1.
Однако, расчёты i дают удовлетворительные результаты, совпадающие с экспериментальными данными для неэлектролитов и первой группы электролитов. В других случаях результаты получаются менее удовлетворительными в связи с зависимостью степени диссоциации от концентрации.
Чтобы определить количество вещества, которое необходимо для получения определённого объёма раствора, используют формулу:
m = 0,29 ´ MV 1000 i
Например. Рассчитать количество КСl, необходимое для получения 250 мл изотонического раствора. М = 74,56 , i =1,86.
0,29´74,56´250
m = _____________ = 2,91г
1,86´1000
Иногда изотоничность растворов достигается с помощью введения других фармакологически индифферентных веществ. Это бывает в тех случаях, когда основное вещество не обеспечивает изотоничности раствора, тогда прибегают к помощи натрия хлорида, натрия сульфата или натрия нитрата и рассчитывают по формуле:

где М2 – молекулярная масса дополнительного вещества;
i2 – изотонический коэффициент дополнительного вещества;
m1 – количество основного вещества, г;
i1 – изотонический коэффициент основного вещества;
М1 – молекулярная масса основного вещества.
Криоскопический метод
Основан на законе Рауля. Закон Рауля определяет зависимость температуры замерзания раствора от концентрации электролита в нем. Понижение точки замерзания разбавленного раствора прямо пропорционально количеству вещества, растворенному в данном количестве растворителя.
D t = KC, где:
D t – депрессия точки замерзания, 0С;
K – константа криоскопии;
С – концентрация раствора.
Под депрессией понимают понижение температуры замерзания раствора вещества по сравнению с температурой замерзания чистого растворителя.
Концентрация раствора находится в прямой зависимости от осмотического давления. Таким образом, и D t (понижение температуры замерзания) будет находиться в прямой зависимости от осмотического давления.
То есть, растворы, имеющие одинаковое осмотическое давление , замерзают при одинаковой температуре.
Зная величину депрессии 1% растворов (D t) и зная что депрессия сыворотки крови в норме равна 0,52С0, можно найти процентную концентрацию вещества, изотоничную сыворотке крови:
D t– 1%
0,52° – C, отсюда С = 0,52*1D t (%)
Чтобы определить количество вещества, которое необходимо взять с целью получения изотонического раствора используют формулу:
m = , 5 2 * V 1 * D t где,
m– количество вещества, необходимое для изотонирования в граммах;
V– объём раствора в мл;
D t - депрессия 1% раствора лекарственного вещества.
При расчете многокомпонентных систем пользуются следующими формулами:
– при двух компонентах прописи:
 ;
;
– при числе компонентов в прописи более двух:
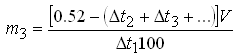 .
.
Расчёты с применением изотонических эквивалентов по натрию хлориду
Изотонический эквивалент лекарственного вещества по натрию хлориду показывает количество натрия хлорида, которое создаёт такое же осмотическое давление, как и 1,0 этого вещества в тех же условиях.
Величина изотонического эквивалента (Е) зависит от природы вещества. Для большинства алкалоидов, синтетических азотистых оснований значение Е находится в пределах от 0,1 до 0,2. Наибольшие величины Е характерны для натрия бромида , натрия гидрокарбоната , натрия нитрата и др.
Для изотонирования глазных капель используются следующие вещества:
- натрия хлорид;
- натрия сульфат;
- борная кислота;
- глюкоза
- натрия нитрат.
Так как величина Е натрия хлорида соответствует 1,0 лекарственного вещества, а для получения 100 мл изотонического раствора требуется 0,9 г натрия хлорида, то количество лекарственного вещества (а), необходимое для получения 100 мл изотонического раствора, т.е. его масообъёмную концентрацию, находят по уравнению:
Е – 1
0,9 – а, отсюда а= 0,9Е ( % )
Пример. Рассчитать изотоническую концентрацию раствора глюкозы Е = 0, 18, а = 0,90,18 = 5 % .
Расчёт количества вещества m (г) для получения определенного объема (Vмл) изотонического раствора проводят по формуле:
m = 0,9 V E 100
Пример. Рассчитать количество натрия бромида, необходимое для получения 300 мл изотонического раствора (ЕNaBr= 0,62),
m= 0,9*3000,62*100=4,35 г NaBr.
Расчёт количества дополнительно добавляемого вещества m (г) для получения V(мл) изотонического раствора, содержащего несколько лекарственных веществ проводят по уравнению:
m = K [ 0,009 V – ( m E 1 + m E 2 + m E i ) где,
m1, m2 , mi – масса лекарственных веществ в прописи;
E1, E2, Ei – их изотонические эквиваленты по NaCl
K – коэффициент, равный для NaCl=1, Na2SO4=4,35, NaNO3= 1,52, глюкозы=5,56 (частное от деления 1 на величины Е указанных веществ).
Пример. Рассчитать количество глюкозы, необходимое для изотонирования 100 мл раствора, содержащего 2 % кальция хлорида и 0,3 % димедрола. Е CaCl2 = 0,36, Е (димедрола ) = 0,2, Е (глюкозы) = 0,18
m = 5,56 [0,009*100 – (2*0,36 + 0,3*0,2)] = 0,67 г глюкозы
Необходимо отметить, что в ряде случаев понятия изоосмотичности и изотоничности нельзя отождествлять, так как их изоосмотические растворы ведут себя по отношению к крови как гипотонические (антипирин, глицерин, новокаин, дикаин, аскорбиновая кислота и другие). Для получения изотонических концентраций этих веществ требуются большие концентрации веществ или добавки изотонирующих веществ.
Осмотическое давление раствора пропорционально общему количеству частиц, образующихся при растворении из 1 молекулы лекарственного вещества. Осмотическое давление выражается в миллиосмолях (мОсм).
Дополнительные требования
Изогидричность - соответствие концентрации водородных ионов инфузионных растворов плазме крови. Значение pH плазмы крови находится в пределах 7,36 - 7,47. Изогидричность достигается введением натрия гидрокарбоната, натрия ацетата и др.
Изоионичность - соответствие ионного состава инфузионных растворов плазме крови. Для поддержания постоянного ионного состава вводят катионы: Na+, K+, Ca2+, Mg2+ ; анионы : Сl-, HCO3-, PO43-, SO4 2- и другие.
Изовязкость. Кровяная плазма человека обладает необходимой вязкостью (0,0015-0,0016 нс/м2) за счёт присутствия в ней растворённых белков. Это требование выполняется введением в состав растворов ВМС.
Дата добавления: 2019-02-22; просмотров: 8199; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
