Закон Максвелла для распределения идеального газа по скоростям.
http://www.pppa.ru/additional/02phy/02/phy05.php
По молекулярно-кинетической теории, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой т0 в газе, находящемся в состоянии равновесия при Т= const. остается постоянной и равной

закон для распределения молекул идеального газа по скоростям: 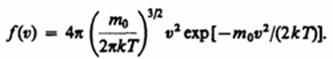
Закон Больцмана для распределения частиц во внешнем потенциальном поле.
Закон распределения частиц по потенциальным энергиям – распределение Больцмана:
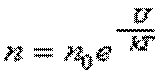
n0 – число молекул в единице объёма там, где U = 0.
Отношение концентраций молекул в точках с U1 и i>U2 равно:
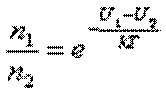
Первое начало термодинамики
Первое начало термодинамики представляет собой закон сохранения энергии, один из всеобщих законов природы (наряду с законами сохранения импульса, заряда и симметрии):
Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем или выведено из каких-либо более общих положений. Истинность этого постулата подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Приведем еще некоторые формулировки первого начала термодинамики:
Полная энергия изолированной системы постоянна;
Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
|
|
|
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU:
Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.
 (I.1)
(I.1)
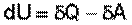 (I.2)
(I.2)
Уравнение (I.1) является математической записью 1-го начала термодинамики для конечного, уравнение (I.2) – для бесконечно малого изменения состояния системы.
Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ΔU не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях:
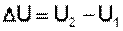 (I.3)
(I.3)
Следует отметить, что определить абсолютное значение внутренней энергии системы невозможно; термодинамику интересует лишь изменение внутренней энергии в ходе какого-либо процесса.
Классическая молекулярно-кинетическая теория теплоёмкости идеальных газов
Теплоемкостью какого-либо тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус. Если сообщение телу количества тепла dQ повышает его температуру на dT, то теплоемкость по определению равна
|
|
|
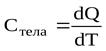 (Дж/К)
(Дж/К)
Молярная теплоемкость при постоянном объеме:
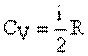
Молярная теплоемкость при постоянном давлении:

Показатель адиабаты:
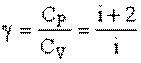
Вывод: теплоемкость идеальных газов согласно классической теории не зависит от температуры.
Дата добавления: 2019-02-22; просмотров: 190; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
