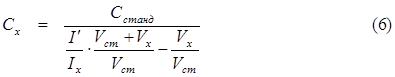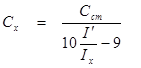Определение кадмия и цинка в водных растворах
КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ Методы анализа, при которых используются процессы поляризации на ртутном капающем электроде (РКЭ), называются полярографическими. Схема простейшей установки для получения поляризационных кривых представлена рис. 1. Ток от аккумулятора 1 поступает на реохорд 2. При его помощи на ячейку (электролизер) 3, содержащую ртутный анод 4 большой поверхности и непрерывно капающий ртутный катод - 5, подается плавно повышающееся напряжение, величину которого можно измерить вольтметром 6. Кривые зависимости величины проходящего через ячейку тока, измеряемой микроамперметром 7, от поданного напряжения называются поляризационными вольтамперными кривыми, или полярограммами. Налагаемое напряжение тратиться на поляризацию РКЭ и на прохождение тока через раствор. Второй электрод (донный ртутный или внешний Рис. 1. Принципиальная схема для регистрации полярограмм. электрод сравнения) практически не поляризуются в силу большой поверхности. Итак, непрерывно увеличивая напряжение, непрерывно изменяем потенциал РКЭ. В отсутствии ионов, способных восстанавливаться, ток через раствор почти не проходит. Кривая I = f (Е) в этом случае имеет вид прямой, практически параллельной оси абсцисс, по которой откладываются значения потенциалов РКЭ, равные по модулю налагаемому напряжению (рис. 2,а). Если в растворе присутствуют ионы, способные восстанавливаться, то по достижении определенного потенциала ионы начинают разряжаться, и через раствор проходит ток. При этом раствор возле РКЭ быстро обедняется ионами, наступает концентрационная поляризация. Концентрация ионов у поверхности РКЭ непрерывно уменьшается, пока не станет практически равной нулю. Концентрация ионов в глубине раствора остается постоянной. Новые количества ионов доставляются к поверхности электрода путем диффузии. Скорость диффузии пропорциональна разности концентраций, которая равна концентрации ионов в глубине раствора. В результате этого через раствор будет проходить предельный ток (в случае применения фона он называется также диффузионным), который не увеличивается при возрастании потенциала. Теперь на кривой I = f (Е) получается ступень, или, как ее обычно называют, волна (рис.2, б). Полярограммы можно зарегистрировать автоматически в потециодинамическом режиме с помощью приборов, называемых полярографами. Рис. 2. Поляризационные кривые: а - в отсутствие электрохимической реакции; б - в присутствии деполяризатора. Рис. 3. Полярограмма раствора, содержащего ионы кадмия и цинка.
|
|
|
При исследовании токов, появляющихся при наложении потенциала на тот или другой тип электрода, мы встречаемся с различными видами токов: конденсаторным или емкостным, током максимума, миграционным, кинетическим, диффузионным. Диффузионный ток имеет наибольшее значение в полярографическом анализе и на закономерностях его возникновения остановимся подробнее.
|
|
|
Высота волны или иначе – величина предельного тока (диффузионного), как это впервые теоретически доказал Илькович, пропорциональна концентрации восстанавливающегося или окисляющегося соединения. Уравнение Ильковича имеет вид:
I пред = Id = 605 nD 1/2 m 2/3 t 1/6 С , (1)
где Id – величина среднего диффузионного тока, мка
n – число электронов потребляемых в электрохимическом процессе
C – концентрация, ммоль/л
D – коэффициент диффузии, см2× c-1
m – масса ртути, вытекающей из капилляра за 1 секунду, мг×с-1
t - время жизни капли, с
Очень важным в полярографическом анализе является уравнение полярографической волны, связывающее потенциал электрода с величиной тока. В случае обратимого процесса это уравнение, впервые полученное Гейровским и Ильковичем, имеет вид:
|
|
|
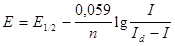 , (2)
, (2)
где E - потенциал в любой точке полярографической волны
I – величина тока в этой точке
E1/2 - потенциал полуволны
Id – предельный диффузионный ток
n - число потребляемых электронов
Природа восстанавливающегося иона характеризуется потенциалом его полуволны E1/2. Для обратимых процессов это величина постоянная, зависящая от природы иона, а также от фона.
Потенциалом полуволны E1/2 называется потенциал середины полярографической волны, не зависящий от концентрации восстанавливаемого (или окисляемого) иона, а зависящий только от его природы.
Качественный полярографический анализ как раз и основан на определении потенциалов полуволн. Допустим, что мы сняли полярограмму исследуемого раствора с использованием в качестве фона 1,0 Н раствора КСl. Полярограмма имеет вид (рис.3) Сопоставим полученные значения потенциалов полуволн с табличными данными, мы можем заключить, что 1-ая волна принадлежит Сd2+, 2-ая - Zn2+.
Как можно определить значения Е1/2?
Не совсем точное определение этой величины можно провести непосредственно по вольт-амперной кривой (рис.4).
|
|
|
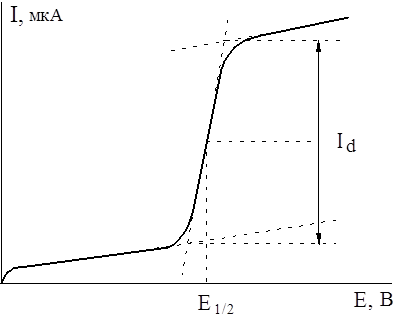
Рис. 4. Определение Е1?2 графическим методом
Точное же определение проводят расчетным путем. Для этого воспользуемся уравнением (2) и перепишем его в виде:
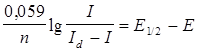 , или
, или
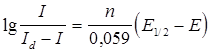 (3)
(3)
В системе координат lg I/Id - f(-E) это уравнение является уравнением прямой с угловым коэффициентом n/0,059. Значение j1/2 определяется весьма просто (рис. 5):
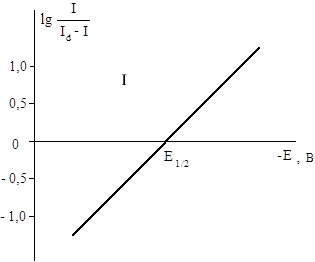
Рис. 5. Определение Е1/2 расчетным методом
В основе количественных полярографических определений лежит уравнение Ильковича (1). Действительно, для какого-либо определенного иона и капилляра с постоянными значениями m и t все величины уравнения (1) будут постоянными, поэтому величина Id будет равна:
Id = КС (4)
Исходя из уравнения (4) можно воспользоваться тремя различными способами количественного определения анализируемых соединений.
1 способ: Метод калибровочных графиков
Наиболее широко в количественном полярографическом анализе применяется метод градуировочного графика, который строят по поданным полярографирования нескольких стандартных растворов.

| На оси ординат откладывается величина диффузионного тока, а по оси абсцисс - концентрация анализируемого вещества (см. рис. 6.). В соответствии с уравнением (4) градуировочный график должен представлять прямую линию, проходящую через начало координат. Метод дает точные результаты при строгой идентичности условий полярогра-фирования стандартных растворов и исследуемой пробы. К условиям полярографирования относят условия работы капилляра, температуру и среду (фоновый |
| Рис. 6. Градуировочный график | электролит). |
Метод градуировочного графика является наиболее трудоемким, но и наиболее точным. Область концентраций, которая является наиболее удобной для полярографического анализа, это 10-2 М – 10-6 М. В области более низких концентраций величина диффузионного тока становится сопоставимым с емкостным током, который не зависит от концентрации деполяризатора. При Концентрация 10 -2 М растворов становится сопоставимой с концентрацией фонового электролита и существенно возрастает влияние емкостного тока.
2 способ: Метод стандартов
Этот метод применяет в том случае, когда приблизительно известно содержание определяемого компонента. Готовят стандартный раствор с концентрацией, близкой к искомой. Снимают полярограмму для стандартного раствора, затем для анализируемого раствора и из основанной на уравнении (4) пропорции
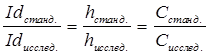 (5)
(5)
рассчитывают концентрацию исследуемого раствора.
3 способ: Метод добавок
По этому методу сначала снимают полярограмму исследуемого раствора, затем к нему добавляют определенный объем (Vст.) типового раствора (с точно известной концентрацией) с таким расчетом, чтобы высота волны возросла приблизительно вдвое.
Расчет количества вещества проводят по формуле:
|
|
Поступление ионов к электроду может происходить не только в результате диффузии, но и за счет передвижения (мигрирования) ионов под влиянием наложенного электрического поля. Это дополнительное движение ионов затрудняет вывод количественных закономерностей при полярографическом анализе, поэтому миграцию ионов нужно свести к нулю. Резкое снижение миграции может быть осуществлено добавкой в раствор значительного избытка посторонних индифферентных ионов, которые восстанавливаются при более отрицательных потенциалах, чем определяемый ион, и поэтому не мешает процессу снятия полярограмм.
В качестве индифферентных электролитов, или иначе – фонов, особенно удобно применять соли, катионами которых являются ионы щелочных и щелочноземельных металлов, а анионами – перхлорат-, сульфат-, хлорат-ионы. Применяют и другие фоны: KCl, HCl, NaOH, NH4Cl + NH4OH (аммиачный буферный раствор) и др. Для определения щелочных металлов в качестве фона используют соли замещенного аммония, для которых потенциалы восстановления имеют еще более отрицательное значение, нежели для ионов щелочных металлов.
Значение фона не ограничивается только подавлением миграционного тока. Фон позволяет сильно увеличить электропроводность раствора, а также в результате комплексообразования он в ряде случаев раздвигает потенциалы полуволн определяемых ионов, поэтому становиться возможным из раздельное определение. Концентрация фона должна в 50-100 раз превышать концентрацию исследуемого вещества.
Кроме подбора определенного фона, для получения четких полярограмм необходимо из анализируемого раствора удалить растворенный в нем кислород. Дело в том, что кислород восстанавливается в две стадии: 1стадия - восстановление кислорода до перекиси водорода (Е1/2 (1)=- 0,2 В); 2 стадия - восстановление перекиси (Е1/2 (2) = - 0,9в), Концетрация растворенного в воде кислорода сопоставима с концентрацией определяемого полярографическим методом вещества, поэтому кислород сильно искажает нужные для определений полярограммы.
Кислород можно удалить длительным продуванием через раствор Н2, N2. Для кислых растворов в качестве газа для продувки можно использовать СО2. Из щелочных растворов кислород удаляют химически путем, добавляя небольшие количества сульфита натрия.
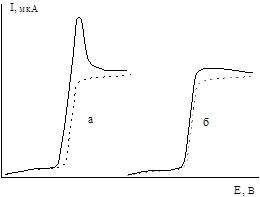
| Довольно часто обычный ход полярограмм сильно искажается полярографическими максимумами, что видно из рис.7 Максимум первого рода объясняется неодинаковой поляризацией поверхности ртутной капли и возникающим при этом дополнительном движении поверхности, что приводит к увеличению доставки деполяризатора (восстанавливающегося вещества) к |
| Рис. 7. Полярограммы с максимумами: а - первого рода; б – второго рода | катоду, т.е. к увеличению Id. |
Максимум второго рода объясняется особенностями вытекания ртути из устья капилляра.
Эти максимумы (1 и 2 рода) могут быть уничтожены добавкой поверхностно активных веществ к раствору; желатин, агар-агар, столярный клей и некоторые другие вещества прекрасно справляются с этой задачей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Определение кадмия и цинка в водных растворах
Необходимые приборы и реактивы:
1) полярографическая установка или полярограф ПУ-1;
2) химические стаканы, пипетки и мерные колбы;
3) сульфат или нитрат кадмия, 10-2 М р-р (по Cd+2 );
4) сульфат или нитрат цинка, 10-2 М р-р (по Zn2+);
5) хлорид калия, 1М раствор;
6) раствор желатины;
7) сульфит натрия Na2SO3
Выполнение работы
Из исходного 10-2 М раствора кадмия (CdSO4) в мерных колбах (50 мл) готовят 4×10-3 М, 2×10-3 М, 1×10-3 М, 5×10-4 М и 2×10-4 М растворы кадмия. Для снятия полярограмм смешивают в стакане по 2 мл приготовленных растворов с 17 мл 1Н КСl и 1 мл раствора желатина. Заливают смесь в ячейку и после 10 минут продувки раствора азотом снимают полярограмму, начиная поляризацию с – 0,4 В относительно насыщенного каломельного электрода (н.к.э.).
Удалить кислород из исследуемого раствора можно также добавляя в него небольшое количество сульфита натрия.
Строят калибровочный график, откладывая по оси абсцисс концентрацию в ммоль/л или моль/л, а по оси ординат – значение найденного из полярограмм предельного диффузионного тока в мкА.
Для определения концентрации исследуемого раствора поступают следующим образом: 2 мл раствора смешивают с 17 мл 1Н КСl и 1 мл раствора желатина, заливают эту смесь в ячейку и после удаления из раствора кислорода снимают полярограмму. По градуировочному графику определяют концентрацию исследуемого вещества.
Аналогичен ход работы при количественном определении цинка, только полярограмму снимают, начиная с –0.8в относительно н.к.э.
Учитывая, что DE1/2 для кадмия и цинка составляет 0,4 B, можно определить одновременно содержание того и другого в растворе, если у нас имеются предварительно полученные калибровочные графики.
Определение свинца
Приборы и реактивы:
полярографическая установка
чистый азот
химические стаканы, пипетки и мерные колбы
нитрат свинца, 10-2 М р-р
нитрат калия, 1н раствор
раствор желатина
Ход выполнения работы аналогичен предыдущему, только в качестве фона можно использовать только нитрат калия, а полярограммы снимают, начиная поляризацию с - 0,10 В относительно н.к.э.
Экспериментальная часть
1 Из исходного 10-2 М раствора сульфата кадмия (CdSO4) в мерных колбах (50 мл) готовят 4·10-3М; 2·10-3М; 1·10-3М; 4·10-4М и 2·10-4 М растворы сульфата кадмия. Для этого в мерные колбы на 50 мл поместить соответственно 20, 10, 5, 2 и 1 мл исходного раствора и довести до метки дистиллированной водой, постоянно перемешивая.
2 Для снятия полярограммы смешать в стакане на 100 мл 2 мл 2·10-4 М раствора CdSO4 с 18 мл 1H КС1 и 5–6 капель раствора желатина. Для удаления растворенного кислорода добавить Na2SO3 и перемешать.
3 Ополоснуть ячейку полученным раствором.
4 Залить этот же раствор в ячейку.
5 Подключить ячейку к полярографу в соответствии с названиями электродов (рабочий, вспомогательный, сравнения).
6 Снять полярограмму, для этого:
а) установить начальный –0,4 В (относительно насыщенного хлорсеребряного электрода);
б) установить диапазон чувствительности записи тока «D », нажав соответствующие кнопки на переключателе «ДИАПАЗОН ТОКА» полярографа,
в) задать определенный масштаб «М» записи тока (ось Y) и потенциала (ось Х) на двухкоординатном самописце;
в) включить ячейку и дождаться стабилизации тока;
г) ручками «УСТАНОВКА НУЛЯ» самописца вывести перо самописца в левую нижнюю часть планшета;
г) включить развертку потенциала кнопкой «ПУСК»;
д) после записи полярограммы отжать перо самописца и нажать кнопку «СТОП» на полярографе.
7 Повторить пункты с 2 по 6 для всех приготовленных растворов.
8 Построить калибровочный график, откладывая по оси абсцисс концентрацию в ммоль/л или моль/л, а по оси ординат – значение найденного из полярограмм предельного диффузионного тока в мкА, расчет тока производится по формуле
 ,
,
где h –высота полярографической волны, см
9 Снять полярограмму (пункты с 2 по 6) для раствора с неизвестной концентрацией кадмия.
10 По калибровочному графику определить концентрацию исследуемого вещества.
11 Проделать пункты с 1 по 9 при количественном определении цинка. ВНИМАНИЕ! Начальный потенциал в этом случае установить –0,8В.
Дата добавления: 2019-02-12; просмотров: 328; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!