Тема: « Элементы VIA -группы Элементы VIIA -группы»»
Занятие №12
Тема: «Свойства элементов IVA - и VA -групп»
Учебно-целевые вопросы
1. Общая характеристика группы. Углерод. Физические и химические свойства простых веществ. Активированный уголь. Карбиды активных металлов и соответствующие им углеводы.
2. Оксид углерода(II), его кислотно-основные и окислительно-восстановительные свойства. Оксид углерода(II) как лиганд, химические основы его токсичности.
3. Дициан и цианистоводородная кислота. Простые и комплексные цианиды. Химические основы токсичности цианидов.
4. Соединения углерода(IV). Оксид углерода(IV), угольная кислота. Карбонаты и гидрокарбонаты: гидролиз, термохимическое разложение.
5. Соединения углерода с галогенами и серой. Тиоцианаты.
6. Кремний, физические и химические свойства. Силициды, соединения с водородом (силаны), окисление, гидролиз. Галогениды. Кислородные соединения, оксид кремния(IV), кремниевая кислота. Природные силикаты и алюмосиликаты.
7. Биологическая роль и химические основы использования соединений углерода и кремния в медицине и фармации.
8. Элементы подгруппы германия. Общая характеристика. Соединения с водородом, галогенами, кислородом. Амфотерность и окислительно-восстановительные свойства оксидов и гидроксидов. Химизм токсического действия соединений свинца, применение в медицине свинецсодержащих препаратов.
9. Азот. Соединения с отрицательными степенями окисления. Нитриды (ковалентные и ионные). Аммиак. Амиды. Катион аммония, его соли, кислотные свойства, термическое разложение. Гидразин и гидроксил
|
|
|
амин. Кислотно-основные и окислительно-восстановительные свойства.
1. Соединения азота в положительных степенях окисления. Оксиды: способы получения, кислотно-основные и окислительно-восстановитель-ные свойства. Азотистая кислота и нитриты, кислотно-основные и окис-лительно-восстановительные свойства. Азотная кислота и нитраты, кислотно-основные и окислительно-восстановительные свойства. «Царская водка».
2. Фосфор. Общая характеристика. Аллотропные модификации фосфора, их химическая активность. Фосфиды. Фосфин.
3. Соединения фосфора в положительных степенях окисления. Оксиды. Фосфорноватистая и фосфористая кислоты, строение молекул, кислотно-основные и окислительно-восстановительные свойства. Пирофосфорная кислота, изополи– и гетерополифосфорные кислоты. Метафосфорные кислоты.
4. Элементы подгруппы мышьяка. Общая характеристика. Водородные соединения мышьяка, сурьмы и висмута. Соединения мышьяка, сурьмы и висмута в положительных степенях окисления.
Задачи и упражнения для самостоятельного решения
|
|
|
1. Какие особенности свойств элемента углерода объясняют многообразие углеродсодержащих соединений?
2. Закончите уравнения практически осуществимых реакций. Укажите условия их протекания и окислительно-восстановительные свойства углерода:
а) Al2O3 + Cизб.; б) CaO + Сизб.; в) С + О2; г) С + СО2;
д) С + S; е) С + N2; ж) С + H2SO4(конц.); з) С + HNO3(разб.)
3. Укажите степень окисления и валентность атома «С» в молекуле СО.
4. Закончите уравнения практически осуществимых реакций, укажите условия их протекания:
а) СО + NaOH; б) СО + Cl2; в) СО + S;
г) Fe3O4 + CO; д) Fe + CO; е) Ni + CO.
5. Какое вещество преимущественно образуется при сгорании угля, если:
а) С + 1/2О2 ® СО (DG = –137 кДж/моль;
б) С + О2 ® СО2 (DG = –394 кДж/моль)
Почему опасность появления угара при закрывании печи уменьшается по мере уменьшения накала углей?
6. Закончите уравнения практически осуществимых реакций:
а) Na2CO3 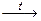 ; б) КНСО3
; б) КНСО3 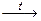 ; в) СаСО3
; в) СаСО3 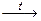 ;
;
г) Са(НСО3)2  ; д) Са(НСО3)2
; д) Са(НСО3)2  ;
;
е) Mg(НСО3)2  .
.
7. В виде каких изомерных форм существует синильная кислота? Какая из этих форм более токсична и в чем заключаются химические основы этой токсичности? Почему соли синильной кислоты необходимо хранить в плотно закрытой посуде? Ответ поясните уравнениями реакций.
|
|
|
8. Какие из перечисленных веществ нельзя хранить в стеклянной посуде:
а) NaOH; б) HF; в) Na2CO3; г) HNO3; д) HCl? Ответ поясните.
9. Напишите уравнение гидролиза Na2SiO3. Как изменится степень гидролиза Na2SiO3 при добавлении к раствору хлорида аммония?
10. В каких из перечисленных ниже соединений есть связи, образованные по донорно-акцепторному механизму: NO2, NO, HNO3, NH3, NH3×H2O, NH 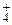 , NH3×BF3? Опишите строение этих соединений.
, NH3×BF3? Опишите строение этих соединений.
11. Напишите уравнения реакций термического разложения следующих солей: (NH4)2CO3; NH4NO3; (NH4)2SO4; NH4NO2; NH4Cl; (NH4)2Cr2O7; (NH4)3PO4; NaNO3; Pb(NO3)2; AgNO3; Cu(NO3)2.
12. Закончите уравнения реакций:
а) N2H4 + KMnO4 + H2SO4 ® N2 + …; б) N2H4 + HCl ® … ;
в) NH2OH + HCl ® ; г) NO2 + Ba(OH)2 ® ; д) Р + HNO3(конц.) ® ;
е) KNO2 + KМnO4 + H2SO4 ® ; ж) KNO2 + KI + H2SO4 ® ;
з) Cu + HNO3(разб.) ® .
13. С какими из перечисленных веществ взаимодействии фосфор: а) O2; б) F2; в) S; г) Н2; д) HNO3(конц.); е) HNO3(разб.); ж) H2SO4(конц.); з) H2SO4(разб.); и) HCl; к) KСlO3; л) NaOH; м) Са; н) Na. напишите соответствующие уравнения реакций, укажите условия и окислительно-восстановительные свойства фосфора.
14. Как получить ортофосфорную кислоту, исходя: а) из свободного фосфора; б) из ортофосфата кальция.
15. Какие вещества и в какой последовательности будут образовываться при постепенном приливании к раствору гидроксида натрия фосфорной кислоты. Напишите соответствующие уравнения реакций в молекулярном и ионном видах.
|
|
|
Занятие № 13
Тема: « Элементы VIA -группы Элементы VIIA -группы»»
Учебно-целевые вопросы
1.Общая характеристика групп. Кислород. Особенности электронной структуры, химическая активность. Классификация кислородных соединений и их общие свойства: супероксиды, пероксиды, оксиды, озониды.
2.Пероксид водорода. Кислотно-основные и окислительно-восстановительные свойства. Химические основы применения кислорода, озона и пероксида в медицине и фармации.
1. Сера. Общая характеристика. Соединения серы в отрицательных степенях окисления. Сероводород, его кислотно-основные и окислительно-восстановительные свойства. Сульфиды металлов и неметаллов. Полисульфиды.
2. Соединения серы(IV) – оксид, хлорид, хлористый тионил, сернистая кислота, сульфиты. Их кислотно-основные и окислительно-восстановительные свойства. Взаимодействие сульфитов с серой с образованием тиосульфатов. свойства тиосульфатов: реакции с кислотами, окислителями (в том числе с иодом).
3. Соединения серы(VI) – оксид, гексафторид, сульфанилхлорид, сульфурилхлорид, серная кислота и ее производные – сульфаты. Кислотно-основные и окислительно-восстановительные свойства. Олеум пиросерная кислоты.
4. Общая характеристика группы. Особые свойства фтора как наиболее электроотрицательного элемента.
5. Соединения галогенов с водородом. Растворимость в воде; кислотно-основные и окислительно-восстановительные свойства.
6. Галогены в положительных степенях окисления. Взаимодействие галогенов с водой и водными растворами щелочей. Кислородные соединения хлора и их соли. Устойчивость, изменение кислотно-основных и окислительно-восстановительных свойств в зависимости от степени окисления галогена. Хлорная известь.
7. Понятие о химизме бактерицидного действия хлора и йода. Применение в медицине, санитарии и фармации хлорной извести, хлорной воды, препаратов активного хлора, иода.
Дата добавления: 2019-01-14; просмотров: 330; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
