Особенности и классификация реакций в органической химии 2 страница
веществами Х1 и Х2 соответственно являются
| 1) | NaOH и HBr | 3) | Al(OH)3 и HBr |
| 2) | NaOH и Br2 | 4) | Al(OH)3 и Br2 |
21. В схеме превращений
X1 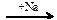 C2H6
C2H6 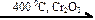 X2
X2
веществами Х1 и Х2 соответственно являются
| 1) | CH3Cl и C2H4 | 3) | C2H4 и CO2 |
| 2) | CH3Cl и C | 4) | CH4 и C6H6 |
22. В схеме превращений
CH3 – CH=CH2  CH3 – CH2 – CH3
CH3 – CH2 – CH3 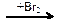 X2
X2
веществами Х1 и Х2 соответственно являются
| 1) | H2O и CH3 – CHBr – CH2Br | 3) | H2 и CH3 – CHBr – CH3 |
| 2) | H2 и CH2Br – CH2 – CH2Br | 4) | H2O и CH3 – CH2 – CH2Br |
23. В схеме превращений
CO  X1
X1 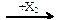 C2H5I
C2H5I
веществами Х1 и Х2 соответственно являются
| 1) | C2H6 и HI | 3) | C2H5OH и КI |
| 2) | C2H6 и I2 | 4) | C2H4 и I2 |
24. Какие из приведенных утверждений об алканах и их свойствах верны?
А. В молекулах алканов атомы углерода соединены между собой только σ-связями.
Б. Качественной реакцией на алканы является обесцвечивание бромной воды.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
25. Какие из приведенных утверждений об алканах и их свойствах верны?
А.В молекулах алканов все связи атома углерода направлены к углам тетраэдра.
Б. Для алканов характерны реакции присоединения.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
26. Какие из приведенных утверждений об алканах и их свойствах верны?
А. Алканы хорошо растворимы в воде.
Б. Для алканов наиболее характерны реакции замещения.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
27. Какие из приведенных утверждений об алканах и их свойствах верны?
|
|
|
А. Общая формула алканов CnH2n+2.
Б. При обычных условиях алканы обесцвечивают раствор перманганата калия.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
28. Какие из приведенных утверждений об алканах и их свойствах верны?
А. Для алканов характерна структурная изомерия углеродного скелета.
Б. Основными природными источниками алканов являются нефть и природный газ.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
29. Какие из приведенных утверждений об алканах и их свойствах верны?
А. Алканы имеют молекулярное строение и молекулярную кристаллическую решетку.
Б. Реакция нитрования алканов протекает по радикальному механизму.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
30. Какие из приведенных утверждений о метане и его свойствах верны?
А. В лаборатории метан можно получить путем гидролиза карбида алюминия.
Б. Пиролиз метана используют для получения сажи.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
31. Какие из приведенных утверждений об алканах и их свойствах верны?
|
|
|
А. В молекулах алканов атомы связаны только одинарными связями.
Б. Метан используется для получения ацетилена.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
32. В соответствии с термохимическим уравнением реакции
2С2Н6(г) + 7О2(г) = 4СО2(г) + 6Н2О(ж) + 3120 кДж
при сгорании 22,4 л (н.у.) этана количество выделившейся теплоты равно
| 1) | 4680 кДж | 2) | 6340 кДж | 3) | 3900 кДж | 4) | 1560 кДж |
33. В результате реакции, термохимическое уравнение которой
С(графит) + 2Н2(г) = СН4(г) + 74,6 кДж,
выделилось 746 кДж теплоты. Масса вступившего в реакцию углерода равна
| 1) | 120 г | 2) | 240 г | 3) | 60 г | 4) | 360 г |
Повышенный уровень сложности
34. Изомерами вещества, молекулярная формула которого С8Н18, являются
| 1) | СН3 ─ (СН2)6 ─ СН3 |
| 2) | СН3 │ СН3 ─ С ─ СН2 ─ (СН2)2 ─ СН3 │ СН3 |
| 3) | СН3 Cl │ │ СН3 ─ С ─ СН2 ─ СН ─ СН2 ─ СН3 │ СН3 |
| 4) | СН3 CH3 │ │ СН3 ─ С ─ СН2 ─ С=СН2 │ СH3 |
| 5) | Н3С CH3 │ │ СН3 ─ С ─ СН ─ СН2 ─ СН3 │ СH3 |
| 6) | СН2=СН ─ (СН2)5 ─ СН3 |
|
|
|
35. Метан можно получить, используя
| 1) | гидролиз карбида кальция |
| 2) | гидролиз карбида алюминия |
| 3) | реакцию Вюрца |
| 4) | сплавление ацетата натрия с гидроксидом натрия |
| 5) | электролиз раствора ацетата натрия |
| 6) | синтез-газ |
36. Этан можно получить, используя
| 1) | гидролиз карбида кальция |
| 2) | гидролиз карбида алюминия |
| 3) | реакцию Вюрца |
| 4) | сплавление пропионата натрия с гидроксидом натрия |
| 5) | электролиз раствора ацетата натрия |
| 6) | реакцию Коновалова |
37. Для алканов характерны
| 1) | хорошая растворимость в воде |
| 2) | sp-гибридизация атомов углерода |
| 3) | наличие только σ-связей между атомами в молекулах |
| 4) | реакции замещения |
| 5) | горение на воздухе |
| 6) | обесцвечивание бромной воды |
38. Для метана характерны
| 1) | плохая растворимость в воде |
| 2) | плоское строение молекулы |
| 3) | наличие водородных связей между молекулами |
| 4) | образование взрывоопасных смесей с воздухом |
| 5) | реакции замещения |
| 6) | реакция дегидратации |
39. Для гептана характерны
| 1) | зигзагообразное строение молекулы |
| 2) | наличие сильно полярных связей между атомами в молекуле |
| 3) | жидкое агрегатное состояние |
| 4) | реакция дегидрирования |
| 5) | горение на воздухе бесцветным пламенем |
| 6) | обесцвечивание раствора перманганата калия |
|
|
|
40. И для этана, и для гексана характерны
| 1) | sp3-гибридизация атомов углерода |
| 2) | отсутствие запаха |
| 3) | газообразное агрегатное состояние |
| 4) | валентный угол 109˚28′ |
| 5) | реакция дегидрирования |
| 6) | изомеризация в присутствии катализатора |
41. Объем воздуха (н.у.), необходимый для полного сгорания 40 л (н.у.) этана, равен _________ л. (Запишите число с точностью до целых.)
42. Объем углекислого газа (н.у.), образующегося при сгорании 10 л пропана в 60 л (н.у.) кислорода, равен _________ л. (Запишите число с точностью до целых.)
43. Объем бутана, который можно сжечь в кислороде объемом 65 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
44. Объем кислорода (н.у.), необходимый для полного сгорания 200 л (н.у.) смеси этана и азота, содержащей 40% по объему этана, равен _________ л. (Запишите число с точностью до целых.)
45. Объем кислорода (н.у.), необходимый для полного сгорания 400 л (н.у.) смеси метана и бутана, содержащей 25% по объему метана, равен _________ л. (Запишите число с точностью до целых.)
46. Карбид алюминия массой 28,8 г полностью прореагировал с соляной кислотой. Объем (н.у.) газа, выделившегося в результате реакции, составил _________ л. (Запишите число с точностью до сотых.)
47. Ацетат натрия массой 41 сплавили с избытком гидроксида натрия. Масса газа, выделившегося в результате реакции, составила _________ г. (Запишите число с точностью до целых.)
48. В результате пиролиза 60 л (н.у.) метана с выходом 80% получили ацетилен, объем (н.у.) которого составил _________ л. (Запишите число с точностью до целых.)
49. Масса газа, полученного по реакции Вюрца между 4,75 г бромметана и 3,0 г натрия, равна _________ г. (Запишите число с точностью до сотых.)
Высокий уровень сложности
50. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C → карбид алюминия 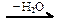 X1
X1 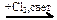 X2 → С2Н6
X2 → С2Н6 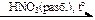 Х3
Х3
Укажите условия протекания реакций.
51. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО → C2H6 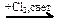 X1 → C3H8
X1 → C3H8 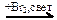 X2
X2 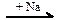 X3
X3
Укажите условия протекания реакций.
52. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH4  Х1 → С2Н6
Х1 → С2Н6  Х2 → CH3СН2СН2СН3 → изобутан
Х2 → CH3СН2СН2СН3 → изобутан
Укажите условия протекания реакций.
53. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C3H7COONa  Х1 → СН3СН=СН2
Х1 → СН3СН=СН2 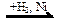 Х1
Х1  Х2
Х2 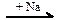 X3
X3
Укажите условия протекания реакций.
54. (С4) Углекислый газ, полученный в результате полного сгорания 3,36 л (н.у.) смеси метана и этана, в которой объемное соотношение газов равно 1:2, пропустили через раствор гидроксида натрия объемом 152,7 мл с массовой долей NaОН 12,0% (плотность 1,31 г/мл). Определите массовые доли веществ в полученном растворе.
55. (С4) Углекислый газ, полученный в результате полного сгорания 0,896 л (н.у.) смеси пропана и бутана, пропустили через избыток известковой воды. В результате выпал осадок массой 14,0 г. Определите объемные доли газов в исходной смеси. 50% пропана, 50% бутана.
56. (С4) Ацетат натрия массой2,46 г сплавили с гидроксидом натрия массой 2,0 г. Твердый остаток растворили в 50 г воды. Определите массовые доли веществ в полученном растворе.
57. (С4) Пропионат калия массой2,24 г сплавили с гидроксидом калия массой 1,68 г. Твердый остаток растворили в 40 мл воды, после чего прилили 39,2 мл 18%-ного раствора хлорида бария (плотность 1,18 г/мл). Определите массовые доли веществ в полученном растворе.
58. (С4) Раствор ацетата натрия массой 200 г подвергли электролизу с инертным анодом до полного разложения соли. Для нейтрализации образовавшейся щелочи потребовалось 32,0 мл 20%-ного раствора соляной кислоты (плотность 1,14 г/мл). Определите массовую долю ацетата натрия в исходном растворе.
59. (С4) Сколько граммов карбида алюминия надо добавить к 250 мл 24%-ного раствора серной кислоты (плотность 1,17 г/мл), чтобы массовая доля соли в полученном растворе стала равна массовой доле кислоты?
60. (С4) Сколько граммов карбида алюминия надо добавить к 200 мл 20%-ного раствора азотной кислоты (плотность 1,1 г/мл), чтобы массовая доля кислоты в полученном растворе стала равна 5%?
61. (С4) Сколько граммов карбида алюминия надо добавить к 300 мл 16%-ного раствора азотной кислоты (плотность 1,09 г/мл), чтобы массовая доля соли в полученном растворе стала равна 10%?
6 2 . (С5) Относительная плотность паров алкана по воздуху равна 3,931. Установите молекулярную формулу алкана.
6 3 . (С5) Массовая доля углерода в алкане равна 83,72%. Установите молекулярную формулу алкана.
64. (С5) Массовая доля хлора в монохлоралкане равна 38,38%. Установите молекулярную формулу монохлоралкана.
65. (С5) Массовая доля кислорода в нитроалкане равна 35,96%. Установите молекулярную формулу нитроалкана.
66. (С5) В результате бромирования алкана массой 6,0 г получили монобромалкан массой 21,8 г. Установите молекулярную формулу алкана.
67. (С5) В результате сгорания алкана получили 13,2 г углекислого газа и 7,2 г воды г. Установите молекулярную формулу алкана.
68. (С5) При сгорании органического вещества массой 9,0 г получили 26,4 г углекислого газа и 16,2 г воды. Плотность паров вещества по кислороду равна 0,9375. Установите молекулярную формулу вещества.
69. (С5) При полном сгорании органического вещества, не содержащего кислород, получили 4,48 л (н.у.) углекислого газа, 3,6 г воды и 2,24 л (н.у.) хлороводорода. Установите молекулярную формулу вещества.
Алкены
Дата добавления: 2019-01-14; просмотров: 2580; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
