ГЕМОЛИТИЧЕСКИЕ ПОСТТРАНСФУЗИОННЫЕ ОСЛОЖНЕНИЯ
Гемолитические трансфузионные осложнения обусловлены иммунным конфликтом, в основе которого - взаимодействие антител реципиента с соответствующими антигенами донорской крови. Гораздо реже гемолиз наступает в результате разрушения эритроцитов реципиента антителами донора. Установлено, что существует два механизма
цитолиза: в кровеносном русле (внутрисосудистый) и в тканях (внесосудистый - в основном в клетках ретикулоэндотелиальной системы, в селезёнке и печени). Антигенам донорских эритроцитов противодействуют специфические антитела, которые способны фиксировать комплемент на поверхности эритроцитов донора. Образовавшийся комплекс антиген + антитело активизирует систему комплемента, что приводит к лизису мембран эритроцитов донора. Клинические признаки гемолиза могут проявиться после трансфузии незначительного объёма несовместимой крови или даже во время биологической пробы. Эти наиболее тяжёлые гемолитические посттрансфузионные осложнения, как правило, связаны с групповой несовместимостью крови донора и реципиента. Антитела способны фиксировать комплемент благодаря наличию на тяжёлых цепях зон, взаимодействующих с С1-компонентом системы комплемента. Резус-антитела не способны фиксировать комплемент и поэтому не вызывают внутрисосудистый гемолиз эритроцитов. При переливании крови, несовместимой по системе резус, происходит внесосудистый гемолиз. Антитела адсорбируются на несовместимые эритроциты. Fc-рецепторы макрофагов, моноцитов печени и селезёнки фиксируют комплекс антиген + антитело, после чего следует фагоцитоз и внутритканевой гемолиз.
|
|
|
Повреждённый эндотелий и тромбоциты вырабатывают серотонин, гистамин, цитокины, тромбоксан, эндотелин, лейкотриены, а разрушение стромы эритроцитов приводит к выделению эритроцитина. Накопление данных медиаторов приводит к активации внутреннего и внешнего механизмов свёртывания крови. Этому же способствует массивный выброс в кровеносное русло тканевого тромбопластина. У пациента возникает коагулопатия потребления (дефицит факторов свёртывания), тромбоцитопения, тромбоцитопатия. В дальнейшем происходит лизис фибрина, фибрин-мономеров, фибриногена, развивается гипоили афибриногенемия, что характерно для фибринолиза. Резко возрастает содержание ПДФ, которые обладают ингибирующим действием на свёртывание крови. На фоне фибринолиза формируются рыхлые тромбы, не способные закрыть просвет повреждённого сосуда, резко возрастает риск тяжёлых геморрагий.
Специфические иммуноглобулины, связываясь с клеточными рецепторами эритроцитов донора, вызывают сладжирование и агглютинацию клеток крови. Это причина развития ДВС-синдрома, сопровождающегося диссеминированной микроэмболизацией, блокадой капиллярного русла, повреждением органов-мишеней и формированием полиорганной недостаточности. Однако в случаях развития
|
|
|
посттрансфузионного гемолитического осложнения в наибольшей степени нарушаются функции почек, при несвоевременном лечении развивается острая почечная недостаточность. ОПН при гемолитических посттрансфузионных осложнениях развивается вследствие:
• гипоксического повреждения почек, канальцевого эпителия;
• блокады микроциркуляции;
• накопления в просвете канальцев почек дериватов свободного гемоглобина.
Эндотоксемия, которая возинкает как результат резкого увеличения содержания в крови билирубина, жёлчных кислот, продуктов метаболизма белков (мочевины, креатинина, мочевой кислоты и др.), довершает клиническую картину гемолитического шока. Смертность в случаях тяжёлых гемолитических осложнений достигает 40-60%. Исход зависит от своевременности диагностики и лечения, при этом ранняя диагностика основана на использовании наиболее доступных лабораторных тестов - на выявлении гемоглобинемии и гемоглобинурии. Содержание непрямого билирубина в крови резко повышается и сопровождается выделением уробилина с мочой и стеркобилина с калом.
|
|
|
После появления первых клинических симптомов гемолитического осложнения трансфузию крови прекращают и немедленно начинают лечение. Его I этап предусматривает ряд симптоматических мероприятий - лечение сердечно-сосудистой недостаточности, применение глюкокортикоидов в больших дозах (по 300 мг болюсно до 2000 мг), коррекция гиповолемии, искусственная вентиляция лёгких, коррекция водно-электролитных и метаболических расстройств, восстановление адекватной перфузии почек, применение медикаментозных методов форсирования диуреза. При сохранении диуреза с темпом мочевыделения более 1 мл/кг/ч внутривенно капельно вводят 250 мг фуросемида (лазикс♠) в 400-600 мл 40% раствора глюкозы*. В случае эффективности диуретиков инфузию продолжают до прекращения гемоглобинурии.
Для успешного лечения гемолитического осложнения необходимо проведение экстракорпоральной детоксикации, цель которой - купирование ДВС-синдрома и эндотоксемии. Применение обменного плазмафереза в ранние сроки клинических проявлений позволяет предупредить развитие полиорганных нарушений, поскольку плазмаферез оказывает положительное влияние на все звенья патологического процесса: во время плазмафереза из циркуляции элиминируются продукты гемолиза, свободный гемоглобин, строма разрушенных клеток, ПДФ, медиаторы воспаления, иммунные комплексы, микроагрегаты клеток
|
|
|
крови. Кроме того, плазмаферез оказывает дренирующий эффект: интерстициальная жидкость активно поступает в сосудистое русло, что способствует детоксикации, улучшению микроциркуляции и реологии крови пациента (Рагимов А.А., Порешина С.А., Салимов Э.Л., 2008).
Одно из условий эффективности обменного плазмафереза - адекватное плазмозамещение, которое позволяет быстро восполнить дефицит факторов свёртывания и естественных антикоагулянтов. Кроме этого, при выраженном дефиците АТ III с целью коррекции его содержания применяют препараты концентрата АТ III в дозе 1500-2000 ЕД в первые сутки лечения.
Выраженность терапевтического эффекта плазмафереза напрямую зависит от объёма эксфузии плазмы, который определяется исходным уровнем свободного гемоглобина в плазме - детоксикации достигают при больших и сверхбольших объёмах (более 1,5- 2 ОЦП за процедуру) плазмообмена. Установлено, что при исходном уровне свободного гемоглобина менее 1000 мг/% в большинстве случаев достаточно удаления одного объёма циркулирующей плазмы (ОЦП). Содержание свободного гемоглобина в плазме, превышающее 2000 мг/%, - показание для удаления двух и более ОЦП (там же).
В случаях нарастания почечной недостаточности показано применение заместительной почечной терапии (гемодиализа, продлённой ультрадиагемофильтрации).
Трансфузии эритроцитарной массы необходимы для коррекции постгемолитической анемии. С целью повышения эффективности и безопасности гемотрансфузий в период свершившегося осложнения необходимо провести фенотипирование эритроцитов реципиента и донора. При тромбоцитопении, геморрагическом синдроме показаны трансфузии концентрата тромбоцитов в терапевтической дозе (6-8 ЕД ТК), а также криопреципитата.
ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Онкологические заболевания повышают риск тромбоэмболических состояний и ДВС. Многие виды опухолей активируют коагуляцию и фибринолиз, поскольку эти процессы облегчают диссеминацию и имплантацию метастатических опухолевых клеток. Особенно высокому риску развития ДВС подвержены пациенты, страдающие диссеминированными формами рака, острыми лейкозами (в первую очередь острым промиелоцитарным), хроническими лейкозами (при бластных кризах).
Развитию тромбоэмболических осложнений при онкологических заболеваниях способствуют высокий уровень клеточного повреждения, распада и выработка клетками злокачественной опухоли прокоагулянтных субстанций, том числе интерлейкина-1 и фактора некроза опухоли, которые стимулируют выработку прокоагулянтов макрофагами и эндотелиальными клетками.
ДВС у данных пациентов протекает в стёртой (субклинической) хронической форме. Однако хирургические вмешательства или инфекционные осложнения часто приводят к обострению ДВС.
Хронический ДВС характеризуется полной или частичной компенсацией гемостаза, но у большинства больных есть специфические изменения показателей свёртывающей системы - увеличивается количество тромбоцитов, возрастает содержание факторов свёртывания, фибриногена, а также продуктов деградации фибриногена, фибрина (табл. 10). Несмотря на это, активация гемокоагуляции носит менее выраженный характер, что подтверждают нормальные показатели свёртывания крови. Уровень АТ III снижается незначительно, активность фибринолитической системы несколько падает.
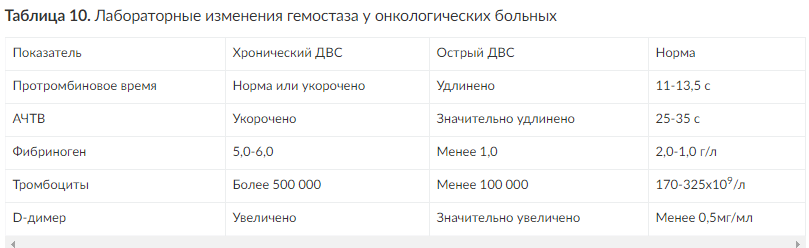
Установлено, что при метастазировании опухолей хронический ДВС диагностируют у 75% больных (Nielsen J.). Нарушения гемостаза нередко проявляются тенденцией к кровоточивости, однако склонность к тромбозам, тромбоэмболическим осложнениям у этих больных представляет намного большую проблему.
Ткань поджелудочной железы богата тканевым фактором и содержит трипсин - протеолитический фермент, который активизирует свёртывающую систему крови. Новообразования поджелудочной железы, панкреатит тяжёлой степени, а также хирургические вмешательства на этом органе резко увеличивают риск развития ДВС или тромбоэмболических осложнений.
Химиотерапия провоцирует обострение хронического ДВС и развитие микроангиопатической гемолитической анемии. При злокачественных опухолях мочевыводящих путей, меланоме и промиелоцитарном лейкозе возможно развитие геморрагического диатеза (капилляротоксикоза). Причина этого осложнения - резкое увеличение продукции ферментов фибринолиза клетками опухоли данной локализации.
Дата добавления: 2018-11-24; просмотров: 739; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
