ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН ВАНТ- ГОФФА
Примеры решения задач
Пример 1.
Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в
1,4 л 63 г глюкозы С6Н12О6 при 0°С.
Решение:
Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
Poc м = nRT / V ,
где п — количество растворенного вещества, моль;
V – объем раствора, м3;
R — молярная газовая постоянная, равная 8,3144 Дж/(моль-К).
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180,16 г/моль. Следовательно, в 1,4л раствора содержится
n= 63/180,16=0,35моль глюкозы.
Осмотическое давление этого раствора глюкозы:
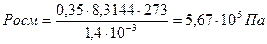
Пример 2.
Определение молекулярной массы неэлектролита по осмотическому давлению раствора.
Рассчитайте молекулярную массу неэлектролита, если в 5л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 0,23∙105 Па при 20°С.
Решение:
Заменив п выражением m / M , где т — масса растворенного вещества, а М — его молярная масса, получим
Росм = mRT /( MV ).
Отсюда молярная масса растворенного вещества равна
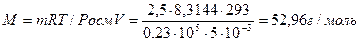
Следовательно, молекулярная масса неэлектролита равна 52,96-
Росм кПа: R=8,31 Дж/моль∙К;
Росм мм Hg ст.: R=62,32 л∙мм.рт.ст./град.∙моль;
Росм. атм.: R=0,082 л∙атм../град.∙моль;
ЗАДАЧИ для самостоятельного решения
|
|
|
4.1. Вычислите осмотическое давление раствора, содержащего 90,08 г глюкозы С6H12O6 в 4 л раствора при 27°С. Ответ: 3,12∙105 Па.
4.2. Найдите осмотическое давление при 0 °С для раствора, содержащего в 1 л 18,4 г глицерина С3Н8О3. Ответ: 4,54∙105 Па.
4.3. Рассчитайте осмотическое давление раствора неэлектролита, содержащего 1,52∙1023 молекул его в 0,5 л раствора при 0 и при 30°С.
Ответ: 11,35∙105 Па; 12,60∙105 Па.
4.4. В 1 л раствора при 25 °С содержится 6,84 г сахара C12H22O11 и 1/38 г этилового спирта С2Н5ОН. Каково осмотическое давление раствора? Ответ:12,39∙104Па.
4.5. При 0 °С осмотическое давление раствора сахара C12H22O11 и равно 3,55∙105 Па. Сколько граммов сахара содержится в 1 л раствора? Ответ: 53,53 г.
4.6. Осмотическое давление раствора, содержащего в 1л 3,2 г неэлектролита, равно 2,42∙105 Па при 20°С. Вычислите молекулярную массу неэлектролита. Ответ: 32,2.
4.7. В 0,5 л раствора содержится 2 г неэлектролита и раствор при 0°С имеет осмотическое давление, равное 0,51∙105 Па. Какова молекулярная масса неэлектролита? Ответ: 178.
4.8. Найдите формулу вещества (маннита), содержащего 39,56% углерода, 7,69% водорода и 52,75% кислорода, если осмотическое давление раствора, содержащего в 1 л 72 г маннита, равно 9,00∙105 Па при 0°С. Ответ: С6H14O6.
|
|
|
4.9. Раствор анилина С6H5NH2 имеет такое же осмотическое давление, что и раствор, содержащий 3,2 г СН3ОН в 1 л воды при 18°С. Сколько граммов анилина содержится в 1 л раствора? Ответ: 9,30 г.
4.10. При какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы С6Н12О6, достигнет 607,8 кПа? Ответ: 19,50С.
4.11. Вычислить осмотическое давление 25%-ного раствора сахара С12H22O11 при 15°С (плотность 1,105 г/мл). Ответ: 1935кПа.
4.12. Сколько граммов глюкозы С6H12О6 содержится в 200 мл раствора, осмотическое давление которого при 37°C составляет 810,4 кПа? Ответ: 11,3 г.
4.13. Осмотическое давление раствора, в 250 мл которого содержится 0,66 мочевины, равно 111,1 кПа при 33°С. Вычислите молекулярную массу мочевины. Ответ: 60,3.
4.14. Сколько молекул растворенного вещества содержится в 1 мл раствора, осмотическое давление которого при 54°С составляет 6065 Па? Ответ: 1,34∙ 1018.
4.15. 1 мм3 раствора содержит 1015 молекул растворенного вещества. Вычислить осмотическое давление раствора при 0°С. В каком объеме раствора содержится 1 моль растворенного вещества? Ответ: 3772 Па; 602 л.
4.16. Из 342 г сахара С12Н22O11 и воды приготовлено 22,4 л раствора. Чему равно осмотическое давление при 0°С?
|
|
|
4.17. Вычислите осмотическое давление 5%-ного раствора ацетона (СН3)2СO в воде при 0°С. Плотность раствора 0,90 г/мл. Ответ: 19 атм.
4.18. Вычислить осмотическое давление раствора при 17°С, если 1 л его содержит 18,4 г глицерина С3Н8O3. Ответ: 4, 76 атм.
4.19. Опытным путем найдено, что осмотическое давление раствора, содержащего 5 г гемоглобина (белковое вещество крови) на 100 мл раствора, при 27°С равно 13,65 мм рт.ст. Вычислить молекулярную массу гемоглобина. Ответ: ~68500.
4.20. В 7 л раствора содержится 24,4 г неэлектролита. Осмотическое давление раствора при 0°С равно 1,3 атм. Вычислить молекулярную массу неэлектролита. Ответ: 60.
4.21. Раствор сахара С12H12О11 при 0°С имеет осмотическое давление, равное 144 мм рт.ст. Сколько граммов сахара содержится в 1 л такого раствора? Ответ: 2,3 г.
4.22. Осмотическое давление раствора глюкозы С6Н12O6 при 0°С равно 4,48 атм. Какова молярность такого раствора? Сколько граммов глюкозы содержит 1 л этого раствора? Ответ: 0,2 моль/л; 36г.
4.23. 40 мл раствора, содержащего 0,2 г растворенного вещества, при 27,3°С обнаруживают осмотическое давление, равное 1,2 атм. Вычислить молекулярную массу растворенного вещества. Ответ: 102,75.
4.24. Выразить в мм рт.ст. осмотическое давление раствора при 0°С, содержащего 6,02∙1017 молекул растворенного вещества в 1 мл раствора. Ответ: 680 мм рт.ст.
|
|
|
4.25. Выразить в мм рт.ст. осмотическое давление раствора при 10°С, содержащего 0,736 г глицерина С3Н803 в 400 мл раствора. Ответ: 553 мм рт.ст.
4.26. Вычислить молярную концентрацию раствора, осмотическое давление которого при 0°С равно 1,12 атм. Ответ: 0,05 моль/л.
4.27. При 0°С осмотическое давление раствора, содержащего 0,550 г гидрохинона в 500 мл раствора, равно 170,2 мм рт.ст. Вычислить молекулярную массу растворенного вещества. Ответ: 110.
4.28. При 0°С осмотическое давление раствора, содержащего 3,04 г дифениламина в 600 мл раствора, равно 510,7 мм рт.ст. Вычислить молярную массу дифениламина. Ответ: 169.
4.29. Сколько воды надо прибавить к 5 л раствора сахара С12Н22O11, чтобы понизить его осмотическое давление с 10,13∙105 до 1,013∙105 Па? Ответ: 45 л
4.30. Во сколько раз повысится осмотическое давление
раствора концентрации 0,1 моль/л при нагревании от 7 до
47°С? Ответ: в 1,14 раза.
Дата добавления: 2018-11-24; просмотров: 8312; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
