Тема 1.12 Окислительно-восстановительные реакции
Введение
1.Подготовить конспект: «Агрегатные состояния вещества» 1час
Кол-во часов:1час
Раздел2. Теоретические основы химии.
Тема1.2Современные представления о строении атома.
Тема самостоятельной работы
2.Подготовить сообщение: «Значение Периодического закона и Периодической системы химических элементов Д. И. Менделеева для развития науки
и понимания химической картины»
Кол-во часов:1час
3.Составление электронных формул элементов 1,2,3, 4 периодов. Определение элементов по электронной формуле
Кол-во часов:1час
Задание: Составить электронные формулы химических элементов 1-4 периодов и определить количество электронов, протонов, нейтронов , заряд ядра атома.
Количество часов: 2часа
Пример
| K | 1s2 2s2 2p6 3s2 3p6 4s1 |
| Ca | 1s2 2s2 2p6 3s2 3p6 4s2 |
| Sc | 1s2 2s2 2p6 3s2 3p6 3d1 4s2 |
| Ti | 1s2 2s2 2p6 3s2 3p6 3d2 4s2 |
Виды заданий
1. натрий
2. кальций
3. хром
4. цинк
5. криптон
Тема 1.5 Дисперсные системы
4.Подготовить сообщение: «Истинные растворы, и их применение»
Кол-во часов:1час
Тема1.3 Строение вещества
Тема самостоятельной работы
Подготовить презентацию: Типы химических связей
Кол-во часов:1час
Тема1.7 Растворы.
Тема самостоятельной работы
6.Подготовить доклад: «Вклад отечественных ученых в развитие теории электролитической диссоциации».
Тема самостоятельной работы
Тема1.7 Растворы.
Тема самостоятельной работы
|
|
|
Решение задач по теме: «Растворы»
Задание: Решение задач по теме : «Растворы»
Количество часов: 1 час
Задача №1. Перед посадкой семена томатов дезинфицируют 15%-ным раствором марганцовки. Сколько г марганцовки потребуется для приготовления 500 г такого раствора? (Ответ: 40 г.)

Задача 2.
В воде растворили 11,2 г КОН. Объём раствора довели до 257мл. Определите молярную концентрацию раствора.
Решение.
1) n(KOH) = m/М = 11,2г/56г/моль = 0,2 моль
2) См(КОН) = 0,2 моль/0,257л = 0,78моль/л.
Ответ: 0,78моль/л.
Задача 3.
К 150 г 20% раствора сахарозы добавили 15 г глюкозы. Рассчитайте массовые доли углеводов в смеси.
Решение.
1)m(C12H22O11) = 150г 0,2 = 30г
2)m^(р-ра) = 150г + 15г = 165г
3)w(C12H22O11) = 30г/165г = 0,182 или 18,2%
4)w(С6Н12О6) = 15г/165г = 0,091 или
Задача 3
Имеется 30% раствор HNO3, имеющий плотность 1,2 г/мл. Какова молярная концентрация этого раствора?
Решение.
1) Примем объем раствора за 1000 мл.
m(р-ра) = 1000 мл 1,2г/мл = 1200г.
2) m(HNO3) = 1200г 0,3 = 360г
3) n(HNO3) = m/М; n(HNO3) = 360г / 63г/моль =5,7 моль
4)См(НNО3) = 5,71моль/л.
Ответ: 5,71моль/л.
Виды заданий:
Задача1.В растворе массой 50г содержится хлорид бария массой 10г. какова массовая доля хлорида бария в растворе.
Задача2.Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200мл, если его молярная концентрация 2моль/л
|
|
|
Задача 3. Молярность раствора едкого кали КОН равна 3,8моль/л, его плотность 1,17г/мл. Вычислить массовую долю КОН в этом растворе.
Задача4. В 200г воды растворили 67,2л хлороводорода НСl(н.у.).Определить массовую долю хлороводорода в полученном растворе
Подготовка доклада «Вклад отечественных ученых в развитие теории электролитической диссоциации
Тема1.7 Растворы.
Тема самостоятельной работы
8.Составление уравнений электролитической диссоциации кислот, щелочей, солей. 1 час
Задание: Составление уравнений электролитической диссоциации кислот, солей, оснований.
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень) – дигидроортофосфат ион
Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион
KOH -> K + + OH -;
NH 4OH ↔ NH +4 + OH –
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH+4+ SO2-4;
Na3PO 4 -> 3 Na + + PO 3-
Диссоциация кислых солей
Диссоциация основных солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
KHSO4 -> K + + HSO -4
HSO -4 ↔ H + + SO 2-4
|
|
|
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg( OH )Cl -> Mg( OH )++ Cl -
Mg ( OH )+↔ Mg2+ + OH-
Виды заданий:
1. K2SO4 ↔
2. NaCl ↔
3. CaCO3↔
4. Н3РО4↔
5. Н2СО3↔
6. НNO3↔
7. HCl↔
8. Fe(OH)3↔
Тема1.7 Растворы.
Тема самостоятельной работы
Задание: Составление уравнений в молекулярной, полной и сокращенной ионных формах.
Количество часов:1час
Выделение газа:
Na2CO3 +H2SO4 → Na2SO4 + H2O + CO2↑
2Na+ + CO32- +2H++ SO42- → 2Na+ + SO42- + H2O + CO2↑ полное ионное уравнение
2H+ + CO32- → H2O + CO2↑ сокращенное ионное уравнение.
Виды заданий:
1.Са(NO3)2 +K2CO3=
2.HNO3+ Ba(OH)2=
3.Ba(NO3)2+K2SO4=
4.K2CO3+HCl=
5.Na2CO3+H2SO4=
Тема 1.7 Растворы .
Тема самостоятельной работы
9.Составление уравнений в ионной форме
Задание: Составление уравнений в молекулярной, полной и сокращенной ионных формах.
Количество часов:1час
Выделение газа:
Na2CO3 +H2SO4 → Na2SO4 + H2O + CO2↑
2Na+ + CO32- +2H++ SO42- → 2Na+ + SO42- + H2O + CO2↑ полное ионное уравнение
2H+ + CO32- → H2O + CO2↑ сокращенное ионное уравнение.
Виды заданий:
1.Са(NO3)2 +K2CO3=
2.HNO3+ Ba(OH)2=
3.Ba(NO3)2+K2SO4=
4.K2CO3+HCl=
5.Na2CO3+H2SO4=
Тема 1.11 Гидролиз солей
Тема самостоятельной работы
10.Подготовить конспект : «Практическое применение гидролиза» 1 час
|
|
|
Тема 1.12 Окислительно-восстановительные реакции
Тема самостоятельной работы
11.Определение степеней окисления химических элементов. Составление ОВР с участием азотной кислоты.
| Алгоритм расстановки коэффициентов |
1.Указываем степени окисления химических элементов.
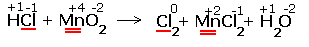 Подчёркнуты химические элементы, в которых изменились степени окисления.
Подчёркнуты химические элементы, в которых изменились степени окисления.
|
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
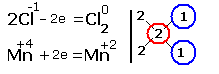 За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно, и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно, и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
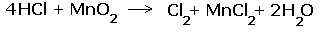
|
-5-
Виды заданий:
1. НNO3HClKMnO4Al2O3 CaSO4 NaNO3 FeSO4
2.K2SO4NaCl CaCO3 CO2 MgO N2O N2O3 N2O5
Задание: Составление ОВР с участием азотной кислоты
1.НNO3+Ca=Ca(NO3)2+ N2O+ H2O
2.HNO3+P=HPO3+NO2↑+ H2O
3.HNO3+ Mg=Mg(NO3)2+NH4NO3+H2O
4. HNO3+Cu(NO3)2+NO+H2O
Тема 1. 14Характерные химические свойства металлов, неметаллов и основных классов неорганических соединений. Водород. Галогены. Халькогены.
Тема самостоятельной работы
12.Подготовить конспект: «Озон, его свойства, получение и применение». 1час
Тема самостоятельной работы
13.Подготовить доклад «Оксиды и соли как строительные материалы» 1 час
Тема самостоятельной работы
14.Подготовить конспект: «Применение соляной кислоты» 1час
Тема самостоятельной работы
15.Подготовить сообщение: «Применение сульфатов, карбонатов и хлоридов». 1час
Тема самостоятельной работы
16Подготовить сообщение : «Применение углекислого газа и кислорода»1час
Тема самостоятельной работы
17.Подготовить сообщение: «Аллотропия фосфора» 1час
Тема самостоятельной работы
18.Подготовить конспект: Соли аммония и их применение 1час
Тема самостоятельной работы
19.Подготовить сообщение: «Применение благородных газов» 1час
Тема самостоятельной работы
20.Подготовить доклад: «Соли кальция и магния, их значение в природе и жизни человека».1час
Тема самостоятельной работы
21.Подготовить доклад: « Роль металлов в истории человеческой цивилизации».1 час
Тема самостоятельной работы
22.Подготовить сообщение: «Применение чугуна и стали.
Тема самостоятельной работы
23.Выполнение упражнений на генетическую связь
Пример №1. Генетический ряд металла.
Металл → Основной оксид → Соль →Основание → Новая соль.
Cu → CuO → CuCl2 → Cu(OH)2 → CuSO4
медь оксид хлорид гидроксид сульфат
меди(II) меди(II) меди(II) меди(II)
Ряд начинается простым веществом металлом медью. Чтобы осуществить первый переход, нужно сжечь медь в атмосфере кислорода.
2Cu +O2 →2CuO
Второй переход: нужно получить соль CuCl2. Она образована соляной кислотой HCl, потому что соли соляной кислоты называются хлориды.
CuO +2 HCl → CuCl2 + H2O
Третий шаг: чтобы получить нерастворимое основание, нужно к растворимой соли прибавить щелочь.
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Чтобы гидроксид меди(II) перевести в сульфат меди(II) прибавим к ней серную кислоту H2SO4.
Cu(OH)2↓ + H2SO4 → CuSO4+ 2H2O
Виды заданий:
1.железо →cульфат железа (ii)→гидроксид железа(ii)→гидроксид железа(iii)→cульфат железа (III)
2. нитрит аммония→азот→ оксид азота (II)→ →оксид азота (IV) →азотная кислота→нитрат меди (II)
3. аммиак→нитрит аммония→гидроксид аммония→аммиак→ оксид азота (II)
4.фосфор→оксид фосфора (V)→ фосфорная кислота→фосфат кальция
Тема самостоятельной работы
24.Решение задач на распознавание веществ.
Тема самостоятельной работы
25.Подготовить конспект: «Виды топлива»
Тема самостоятельной работы
26.Решение задач на распознавание веществ.
Тема самостоятельной работы
Раздел.2 Органическая химия.
Дата добавления: 2018-11-24; просмотров: 155; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
