Тема 4. Растворы. Дисперсные системы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«БРАТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Естественнонаучный факультет
Кафедра «ЭБЖиХ»
Дисциплина «Химия»
КОНТРОЛЬНАЯ РАБОТА
ВАРИАНТ 7
| Выполнил: | группа | ||
| ФИО |
| ||
|
| |||
| Принял: | доцент | ||
|
| |||
| Проверил | доцент | ||
Тема 1. Строение вещества
Задание
1. Напишите электронные формулы атомов, образующих молекулы SClF5; LiH
Электронная формула S: 1s22s22p63s23p4
Электронная формула Cl: 1s22s22p63s23p5
Электронная формула F: 1s22s22p5
Электронная формула Li: 1s22s1
Электронная формула H: 1s1
2. Определите механизм образования связи и ее вид
SClF5 – ковалентная полярная связь, механизм образования связи – обменный
LiH – ковалентная полярная связь, механизм образования связи – обменный
3. Определите полярность молекулы
SClF5 – полярная молекула, ввиду того, что полярные связи S-F и S-Cl располжены симметрично, при этом полярность связей у них различная. Оставшиеся четыре атома фтора расположены симметрично в плоскости, они образуют плоский квадрат, и не вносят дополнительного дипольного момента.
LiH – полярная молекула, ввиду полярности связи H-Li
4. Укажите, имеет ли место гибридизация, ее тип
SClF5 - гибридизация центрального атома sp3d2
|
|
|
LiH – гибридизации нет, связь H-Li образована s-электроном атома Li и s-электроном атома Н.
5. Покажите геометрическую структуру молекулы
SClF5 – искаженный октаэдр
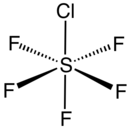
LiH – линейная молекула
Тема 2. Основные понятия химической термодинамики
Задание
1. Запишите уравнение реакции PCl5(г)=PCl3(г)+Cl2(г)
2. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции
1. Определим по таблицам ΔНобр всех продуктов и реагентов:
| ΔНобр(PCl5(г)), кДж/моль | ΔНобр(PCl3(г)), кДж/моль | ΔНобр(Cl2(г)), кДж/моль |
| –369,45 | –277,0 | 0 |
2. Запишем закон Гесса для данной реакции:
ΔНр = ΔНобр(PCl3(г)) – ΔНобр(PCl5(г)) = –277,0 – (–369,45) = 92.45 кДж/моль
3. Определим энтропию данной реакции:
| Sобр(PCl5 (г)), Дж/моль·K | S(PCl3(г)), Дж/моль·K | S(Cl2 (г)), Дж/моль·K |
| 362,9 | 311,7 | 223,0 |
Sр = Sобр(PCl3 (г)) + 2Sобр(Cl2 (г)) – Sобр(PCl5 (г)) = 311,7 + 223,0 – 362,9 = 171.8 Дж/моль·K
3. Определите, в каком направлении при 298 К (прямом или обратном) будет протекать реакция, если все ее участники находятся в стандартном состоянии
Рассчитаем энергию Гиббса для данной реакции:
ΔGp = ΔH – TΔS = 92450 – 298 · (171.8) = 41.254 кДж/моль
Так как энергия Гиббса для данной реакции положительная:
|
|
|
ΔGp = 41.254 кДж/моль > 0, следовательно, реакция проходит в обратном направлении
Тема 3. Химическая кинетика и катализ
Задание
1. Напишите выражение константы гетерогенного химического равновесия для равновесной химической реакции FeO(к)+H2(г)=Fe(к)+H2O(г)

2. Оцените, в какую сторону сместится равновесие данной системы при повышении температуры
Для определения, в какую сторону сместится равновесие данной системы при повышении температуры, необходимо рассчитать, экзотермическая или эндотермическая эта реакция.
Как в прошлом примере, определим энтропию реакции:
1. Определим по таблицам ΔНобр всех продуктов и реагентов:
| ΔНобр(Fe(к)), кДж/моль | ΔНобр(Н2О(г)), кДж/моль | ΔНобр(FeO(к)), кДж/моль | ΔНобр(H2(г)), кДж/моль |
| 0 | – 241,84 | – 264,8 | 0 |
2. Запишем закон Гесса для данной реакции:
ΔНр = ΔНобр(Fe(к)) + ΔНобр(H2O(г)) – ΔНобр(FeO(к)) – ΔНобр(H2(г))
ΔНр = (– 241,84) – (– 264,8) = 22.96 кДж/моль.
Следовательно, данная реакция эндотермическая, и соответственно, при повышении температуры равновесие сместится в сторону прямой реакции.
3. Нарушится ли равновесие в данной системе, если уменьшить давление в два раза.
При уменьшении давления в два раза равновесие не сместится, так как изменение давления одинаково влияет и на прямую реакцию, и на обратную:
|
|
|

Тема 4. Растворы. Дисперсные системы
Задание
1. Из приведенных в табл. веществ (см. столбцы 1-3) выберите сильные и слабые электролиты и составьте уравнение их диссоциации в водном растворе.
2. В столбце 1а даны значения молярных концентраций для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора, определите молярную концентрацию эквивалента, массовую долю вещества, принимая его плотность равной 1 г/см3.
3. Рассчитайте рН раствора сильного электролита из столбцов 1 и 2 для соответствующей концентраций, данных в столбцах 1а и 2а.
4. Напишите уравнение гидролиза соли, данной в столбце 3, по всем возможным ступеням и выражение констант гидролиза по этим ступеням.
Таблица исходных данных
| Вариант | Наименование вещества | Концентрация вещества | |||
| 1 | 2 | 3 | 1а | 2а | |
| 7 | LiOH | H3PO4 | HCOONa | 0,005 | 0,02 |
1. В столбце 1а даны значения молярных концентраций для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора, определите молярную концентрацию эквивалента, массовую долю вещества, принимая его плотность равной 1 г/см3.
|
|
|
Определим количество вещества эквивалента в 1 литра раствора.
n(LiOH) = c(LiOH) · V = 0.005 · 1 = 0.005 моль
Число эквивалентности Z = 1 (число эквивалентности для основания равно количеству гидроксильных групп в формульной единице)
nЭ(LiOH) = c(LiOH) · 1 = 0.005 · 1 = 0.005 моль-экв
Тогда молярная концентрация эквивалентов будет:
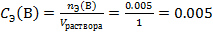 моль-экв/л.
моль-экв/л.
Определим массовую долю вещества.
1. Рассчитаем массу 1 л раствора:
ρ(раствора) = 1 г/см3 = 1000 г/л.
m(раствора) = V · ρ = 1 л · 1000 г/л = 1000 г.
2. Рассчитаем массу основания в 1 л раствора
n(LiOH) = 0.005 моль
m(LiOH) = M(LiOH) · n(LiOH) = (7 + 16+1) · 0.005 = 24 г/моль · 0.005 моль = 0,12 г.
3. Определим массовую долю гидроксида стронция:
w(LiOH) = m(LiOH)/m(раствора) = 0,12 / 1000 = 0,012%.
2. Рассчитайте рН раствора сильного электролита из столбцов 1 и 2 для соответствующей концентраций, данных в столбцах 1а и 2а.
1. Рассчитаем рН раствора гидроксида стронция LiOH.
LiOH « Li+ + 2H-
Принимая его степень диссоциации равной 100%, можно сказать, что
с(LiOH) = с(Li+) = 0.005 моль/л.
Тогда
c(OH-) = c(Li+) = 0.005 · 1 = 0.005 моль/л.
рОН = -lg(c(OH-) = -lg(0.005) = 2,3
Тогда
рН = 14 – рОН = 14 – 1.4 = 11,7
Ответ: рН(LiOH) = 11,7
2. Рассчитаем рН раствора фосфорной кислоты.
Диссоциация фосфорной кислоты проходит ступенчато:
H3РO4 « H+ + H2РO4- Kдисс = 7,1 · 10–3
H2РO4- « H+ + HРO42- Kдисс = 6,2 · 10–8
HРO3- « H+ + РO43- Kдисс = 5,0 · 10–13
Очевидно, что вторая ступень диссоциации незначительно влияет на рН раствора кислоты.
Будем проводить расчет по первой ступени диссоциации.
Константа равновесия этого процесса (она же константа диссоциации) имеет вид:
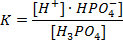
Из стехиометрического уравнения следует, что
[HPO4-] = [H+],
а равновесная концентрация селенистой кислоты будет равна:
[H3PO4] = c0(H3PO4) – [H+].
Подставив значения равновесных концентраций в выражение для Kдисс, получим:
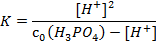
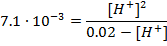
7.1∙10-3 · (0.02 – [H+]) = [H+]2
[H+]2 + 7.1∙10-3 · [H+] – 1.42 · 10-4 = 0
Решив квадратное уравнение, получаем значение [H+]:
[H+] = 0,016 моль/л
pH = – lg[H+],
pH = 1,8
Ответ: pH = 1,8.
3. Напишите уравнение гидролиза соли, данной в столбце 3, по всем возможным ступеням и выражение констант гидролиза по этим ступеням.
HCOONa + H2O « НСООН + NaOH – молекулярный вид уравнения
Na+ + НСОО- + H2O « НСООН + Na+ + OH- – полный ионный вид уравнения
НСОО- + H2O « НСООН + OH- – сокращенный ионный вид уравнения
Выражение константы:

Дата добавления: 2018-11-24; просмотров: 302; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
