Особенности золей и суспензий
Золи относятся к высокодисперсным системам; их называют коллоидными растворами. Кроме того, в зависимости от дисперсионной среды различают гидрозоли (вода) и органозоли (органическая среда); расплавы, содержащие высокодисперсные частицы, относятся к пирозолям. С изучения свойств золей зародилась коллоидная химия.
Помимо частиц дисперсная фаза золей может формироваться из мицелл — электрически нейтральных агрегатов ионов дисперсионной среды, размеры которых соответствуют размерам частиц высокодисперсных систем, т.е. 1—100 нм (см. параграф 7.2); кроме того, мицеллы образуют растворы коллоидных ПАВ (см. параграф 21.2).
Суспензии являются средне- и грубодисперсными системами. В этом они качественно отличаются от золей. Сравнительную характеристику золей и суспензий как дисперсных систем типа Т/Ж можно представить следующим образом:
Золи Суспензии
Класс дисперсных Высоко- Средне- и грубо-
систем дисперсные дисперсные
Седиментационная Обладают Не обладают
устойчивость
Молекулярно- Проявляются Проявляются слабо
кинетические в полной мере
свойства
|
|
|
Электрокинетические То же Проявляются
явления частично
Рассеяние света Имеет место Отсутствует
Адсорбция и То же Имеет место
образование ДЭС
Связнодисперсные Гели Пасты
системы
Золи — это седиментационно-устойчивые системы. Жидкая дисперсионная среда золей позволяет молекулярно-кинетическим явлениям проявиться наиболее интенсивно (см. рис. 1.2, кривая 1). Суспензии, наоборот, седиментационно-неустойчивы; молекулярно-кинетические явления их выражены слабо (см. гл. 9). При одной и той же массовой концентрации vм удельная поверхность частиц золя значительно превышает удельную поверхность частиц суспензии (см. рис. 1.2, кривая 2), что обусловливает интенсивность всех поверхностных явлений.
Особенно резко различаются оптические свойства золей и суспензий. Золи способны рассеивать свет по закону Рэлея, а суспензии преимущественно поглощают свет (см. параграф 8.2).
|
|
|
Общие свойства золей и суспензий определяются границей раздела фаз Т—Ж, на которой происходят адсорбционные процессы и образуется двойной электрический слой. Больший размер частиц суспензий по сравнению с размером частиц золей приводит к тому, что электроосмос и потенциал течения для суспензий выражен слабо, а электрофорез практически невозможен (см. гл. 7 ).3оли могут быть лиофильными и лиофобными (см. параграф 10.4). K лиофобным агрегативно неустойчивым относятся гидрозоли платины, золота, серебра и сульфидов.
Гидрофильными агрегативно устойчивыми золями являются мицеллы коллоидных IIAB (см. гл. 21), красители, а применительно к пищевым массам - высокодисперсные частицы муки, белки, углеводы, пектин, мякоть томатного сока. К суспензиям относятся зародыши и мезга кукурузного крахмала, продукты изомеризации жирных кислот и пигменты неочищенного растительного масла.
В ржаной отбойной муке, например, содержится 4—6% растворимых коллоидов. Гидрофильность, т.е. сродство к воде золей различных видов муки, возрастает в ряду соевая > гороховая > ржаная > пшеничная > гречишная > картофельная. Суспензии часто получают в процессе приготовления пищи (например, протертые супы).
|
|
|
Суспензии используются для осуществления некоторых технологических процессов. Адсорбционное рафинирование (отбеливание) растительного масла основано на использовании суспензии, которая образуется из частичек бентонитовых глин, выполняющих роль адсорбента.
Пасты, гели и осадки как структурированные системы
При увеличении концентрации частиц дисперсной фазы системы из свободнодисперсных превращаются в связнодисперсные. Связнодисперсные системы, в которые переходят суспензии, называют пастами. Золи переходят в гели. Пасты и гели образуют структуры, и для них характерны структурно-механические свойства, которые были рассмотрены ранее (см. гл. 11).
Пасты представляют собой концентрированные суспензии или осадок, который образуется в результате потери суспензией седиментационной устойчивости. Кроме того, пасты могут быть приготовлены искусственно путем растирания твердых тел или порошков в жидкой среде.
Осадки золей в отличие от осадков суспензий могут переходить обратно в коллоидный раствор.
Этот процесс, обратный коагуляции, т.е. распад агрегатов до первичных частиц и переход части осадка во взвешенное состояние, называется пептизацией. Для высокодисперсных систем динамическое равновесие между коагуляцией и пептизацией можно представить следующим образом:
|
|
|
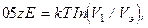 (14.1)
(14.1)
где Е — энергия связи между частицами; z — координационное число частицы в пространстве агрегата; V1 — объем, приходящийся на одну частицу; Vэ — эффективный объем, в котором происходит смещение частиц относительно положения равновесия в агрегатах; k — постоянная Больцмана.
Для лиофильных дисперсных систем, которые характеризуются низким межфазовым поверхностным натяжением и незначительной энергией связи Е, реализуется условие 0,5 zE < kT ln(V1/Vэ), и коагуляция термодинамически невозможна. В лиофобных системах, когда энергия связи частиц Е значительна, коагуляцию можно считать практически необратимой.
Пептизация может протекать под действием электролитов, при этом восстанавливается ДЭС, повышается ζ-потенциал, а силы электростатического отталкивания преобладают над силами межмолекулярного взаимодействия (см. рис. 10.5). Пептизация также может происходить под действием растворов ПАВ, молекулы которых адсорбируются на границе раздела фаз и образуют адсорбционные слои, способные противодействовать сближению частиц.
 В результате действия электролитов или растворов ПАВ между частицами возникает дополнительная сила отталкивания. Связь и контакт между частицами нарушаются, осадок распадается на отдельные частицы коллоидного размера. Эти частицы из области большей концентрации (осадок) переходят за счет диффузии в область меньшей концентрации, т.е. во взвешенное состояние, образуя золь.
В результате действия электролитов или растворов ПАВ между частицами возникает дополнительная сила отталкивания. Связь и контакт между частицами нарушаются, осадок распадается на отдельные частицы коллоидного размера. Эти частицы из области большей концентрации (осадок) переходят за счет диффузии в область меньшей концентрации, т.е. во взвешенное состояние, образуя золь.
 Пептизация протекает с определенной скоростью и зависит от концентрации электролита-пептизатора (рис. 14). В начале процесса при незначительной концентрации электролита переход осадка в раствор не наблюдается (участок I) — происходит адсорбция пептизатора на поверхности частиц. По мере увеличения концентрации пептизатора (участок II) количество осадка, перешедшего в коллоидный раствор, резко возрастает. При дальнейшем увеличении концентрации пептизатора весь осадок переходит в коллоидный раствор (участок III).
Пептизация протекает с определенной скоростью и зависит от концентрации электролита-пептизатора (рис. 14). В начале процесса при незначительной концентрации электролита переход осадка в раствор не наблюдается (участок I) — происходит адсорбция пептизатора на поверхности частиц. По мере увеличения концентрации пептизатора (участок II) количество осадка, перешедшего в коллоидный раствор, резко возрастает. При дальнейшем увеличении концентрации пептизатора весь осадок переходит в коллоидный раствор (участок III).
Г л а в а 15
ЭМУЛЬСИИ
Эмульсии представляют собой особый вид дисперсных систем, дисперсная фаза и дисперсионная среда которых являются взаимно нерастворимыми или плохо растворимыми жидкостями. Это обстоятельство и обусловливает специфическое свойство эмульсий образовывать системы со сферическими частицами дисперсной фазы в широком диапазоне концентрации (от 0,001 до 90%) и их способностью к обращению фаз. Получение, устойчивость и разрушение эмульсий определяются особенностями границы раздела Ж—Ж.
Эмульсии, как и другие дисперсные системы, широко применяют в различных отраслях промышленности; они определяют свойства некоторых продуктов питания.
Свойства эмульсий
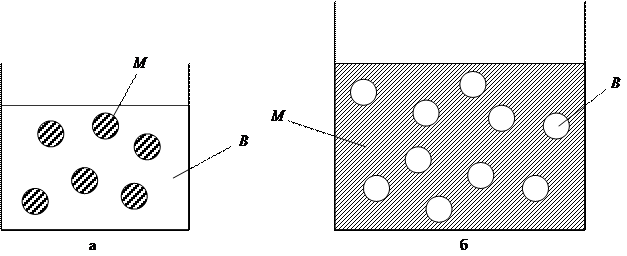
Наибольший практический интерес представляют эмульсии, в которых одной из жидких фаз является вода (В), а другая формируется из водонерастворимой жидкости, называемой в общем случае маслом (М); это может быть жидкий жир, минеральные масла и др.
В зависимости от состава дисперсной фазы и дисперсионной среды могут быть прямые и обратные эмульсии. Прямые эмульсии типа М/В — это дисперсии масла в воде. Раздробленной фазой в прямых эмульсиях является масло (рис. 15.1). Обратные эмульсии типа В/М — это дисперсии воды в масле, в них частицы воды распределены в масляной среде. Прямой эмульсией является молоко, а маргарин и нефть можно отнести к обратным эмульсиям.
Тип эмульсии можно определить экспериментально. Для этой цели в эмульсию добавляют некоторое количество жидкости, составляющую одну из фаз. Если эмульсия легко разбавляется, то добавляемая жидкость проникает в непрерывную часть системы, которая и будет дисперсионной средой.
Определить тип эмульсии можно при помощи красителя, растворимого только в одной из фаз. Если краситель растворяется в дисперсионной среде, то эмульсия быстро окрашивается в цвет этого красителя. Обычно прямая эмульсия (М/В) обладает большей электропроводностью по сравнению с обратной эмульсией (В/М).
Эмульсии различают в зависимости от содержания дисперсной фазы, которая выражается через объемную концентрацию:
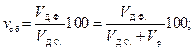 (15.1)
(15.1)
где Vд.ф., Vр и Vд.с. — объем дисперсной фазы, дисперсионной среды (растворителя) и дисперсной системы, в данном случае эмульсии, соответственно.
В зависимости от концентрации дисперсной фазы эмульсии могут быть разбавленными (vоб < 0,1%), концентрированными (0,1% < vоб < 74%) и высококонцентрированными при vоб > 74%.
В разбавленных эмульсиях концентрация дисперсной фазы незначительна. Поэтому их свойства (вязкость, плотность и др.) мало отличаются от свойств дисперсионной среды.
Стремление поверхностной энергии к минимуму (см. рис. 2.4) вследствие подвижности жидкой границы в эмульсиях приводит к самопроизвольному снижению поверхности раздела фаз. По этой причине капли разбавленных и концентрированных эмульсий приобретают шарообразную форму.
Объемная концентрация vоб, равная 74%, является рубежом, характеризующим переход концентрированной эмульсии в высококонцентрированную. При vоб менее 74% частицы дисперсной фазы способны сохранять сферическую форму и плотную упаковку частиц одного и того же размера. Плотная упаковка означает расположение частиц дисперсной фазы таким образом, что объем дисперсионной среды, становится минимальным.
При концентрации дисперсной фазы выше 74% наблюдается деформация капель дисперсной фазы, их сферичность нарушается, а эмульсии приобретают новые свойства. Жидкие пленки превращаются в многогранники, сформированные из дисперсионной среды. Высококонцентрированные эмульсии могут содержать до 99% дисперсной фазы. Подобные эмульсии образуют структуру, способны сохранять свою форму, и не растекаются. Именно к эмульсиям такого типа относятся сливочное масло, маргарин и различные кремы.
Значительная часть эмульсий относится к средне- и грубодисперсным системам, размеры частиц дисперсной фазы которых превышают 1 мкм. Майонез, например, представляет собой концентрированную прямую эмульсию (vоб = 40¸ 70%) в воде типа М/В. Размеры жировых шариков колеблются в пределах 1—10 мкм.
 В настоящее время все большее значение приобретают микроэмульсии; дисперсная фаза таких эмульсий состоит из набухших мицелл коллоидных ПАВ (см. параграфы 21.4 и 21.5). Поэтому микроэмульсии называют еще мицеллярными эмульсиями. Размер мицелл дисперсной фазы этих эмульсий составляет 10—100 нм, что соответствует высокодисперсным системам. Микроэмульсии обычно устойчивы. Концентрация vоб может достигать 50%, что соответствует концентрированным эмульсиям.
В настоящее время все большее значение приобретают микроэмульсии; дисперсная фаза таких эмульсий состоит из набухших мицелл коллоидных ПАВ (см. параграфы 21.4 и 21.5). Поэтому микроэмульсии называют еще мицеллярными эмульсиями. Размер мицелл дисперсной фазы этих эмульсий составляет 10—100 нм, что соответствует высокодисперсным системам. Микроэмульсии обычно устойчивы. Концентрация vоб может достигать 50%, что соответствует концентрированным эмульсиям.
Устойчивость эмульсий
Устойчивость эмульсий, как и других дисперсных систем — в том числе и с жидкой дисперсионной средой, определяет время их жизни и является важнейшим фактором, обусловливающим применение эмульсий. Однотипность агрегатного состояния двух смежных фаз определяет особенности устойчивости эмульсий.
Эмульсии могут быть лиофильными и лиофобными. Лиофильные эмульсии термодинамически устойчивы и образуются самопроизвольно путем диспергирования массы жидкости до капель определенного размера. Лиофильных эмульсий немного.
Большинство эмульсий относится к лиофобным системам. Они термодинамически неустойчивы, не могут образовываться самопроизвольно, существовать длительное время и нуждаются в стабилизации. Разрушение и потеря агрегативной устойчивости эмульсий проходят в несколько стадий. Первая из них обусловлена контактом между собой по крайней мере двух капель. Вероятность подобного контакта для разбавленных эмульсий незначительна; по этой причине лиофобные разбавленные эмульсии обладают относительно большой агрегативной устойчивостью.
Процесс разрушения эмульсии после контакта капель схематически был показан ранее на рис. 10.3. После коагуляции капель 1 образуются агрегаты 2 (вторая стадия), которые в результате коалесценции могут сливаться в одну большую каплю 3. Коалесценцию можно рассматривать как третью стадию процесса разрушения эмульсий,
Концентрированные и высококонцентрированные эмульсии, относящиеся к лиофобным системам, агрегативно неустойчивы. Электростатические силы отталкивания, которые действуют между частицами в эмульсиях, незначительны. На границе раздела жидкость — жидкость поверхностный заряд распределяется диффузно в обеих жидких фазах. Это приводит к значительному снижению электрического φ-потенциала и слабому электростатическому отталкиванию (см. рис. 7.3).
После контакта твердых частиц дисперсной фазы суспензий и золей граница раздела фаз сохраняется, а после столкновения капель эмульсий в результате коалесценции граница раздела фаз между каплями исчезает. Это обстоятельство также определяет меньшую устойчивость эмульсий по сравнению с суспензиями и особенно c золями. Устойчивость эмульсий зависит от ряда причин: поверхностного межфазового натяжения на границе двух жидкостей σЖЖ, а также свойств и структуры граничных слоев, окружающих капли дисперсной фазы.
С учетом элементарного акта взаимодействия капель, условий самопроизвольного диспергирования жидкости, баланса сил притяжения и отталкивания (см. рис. 10.5) разработан ряд критериев, определяющих агрегативную устойчивость дисперсных систем, в том числе и эмульсий.
В случае, когда исчезает межфазовая граница и имеет место коалесценция, таким критерием агрегативной устойчивости может быть критическое значение межфазового поверхностного натяжения, которое, согласно Ребиндеру-Щукину, составляет
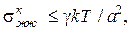 (15.2)
(15.2)
где γ — числовой коэффициент, значения которого равны примерно 10–7; k — постоянная Больцмана; а — диаметр частиц.
Критическое значение межфазового поверхностного натяжения согласно Ли и Тадроса может быть рассчитано следующим образом:
σкжж ≤ 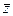 ΔF*/(2ка2), (15.3)
ΔF*/(2ка2), (15.3)
где 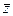 — среднее координационное число упаковки, определяющее число контактов частицы с соседними частицами: ΔF* — свободная энергия Гельмгольца, характеризующая процесс диспергирования (свободная энергия диспергирования).
— среднее координационное число упаковки, определяющее число контактов частицы с соседними частицами: ΔF* — свободная энергия Гельмгольца, характеризующая процесс диспергирования (свободная энергия диспергирования).
Условия (15.2) и (15.3) позволяют определить критическое межфазовое поверхностное натяжение, ниже которого возможно самопроизвольное диспергирование (переход лиофобных систем в лиофильные). По расчетам авторов, такой переход, согласно условию (15.2), возможен, когда дисперсная фаза формируется из капель диаметром 0.01 мкм, при значении межфазового поверхностного натяжения, равном десятым и даже сотым долям мДж/м2. Если ΔF* = 10kT, размер капель 0,01 мкм, а координационное число z равно 6, то, согласно условию (15.3), критическое межфазовое поверхностное натяжение будет составлять десятые доли мДж/м2.
Для коагуляции, когда между контактирующими каплями сохраняется слой жидкости и имеет место paсклинивающее давление (см. рис. 10.5), в случае ближнего минимума и при минимальной толщине слоя жидкости В.Г.Бабаком получен следующий критерий агрегативной устойчивости (КАУ):
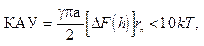 (15.4)
(15.4)
где ΔF(h) — свободная энергия процесса диспергирования, выраженная через энергию Гельмгольца в зависимости от расстояния h между каплями; r n— радиус действия сил притяжения.
В условии (15.4) в отличие от (15.2) и (15.3) не фигурирует межфазовое поверхностное натяжение.
Ранее было показано (см. параграф 10.6), что межфазовое поверхностное натяжение не может однозначно характеризовать агрегативную устойчивость эмульсий. Форма изотермы расклинивающего давления (см. рис. 10.5, б) и внешнее давление, осуществляющее прижим и деформацию капель, влияют на агрегативную устойчивость. Снижение межфазового поверхностного натяжения способствует агрегативной устойчивости в том случае, если на изотерме расклинивающего давления отсутствует потенциальный барьер. В противоположном случае, т.е. при наличии этого барьера, снижение межфазового поверхностного натяжения не приводит к росту агрегативной устойчивости.
В условие (10.35), определяющее устойчивость эмульсий, входит внешняя сила рк, которая вызывает деформацию капель, а работа деформации может в 1000 раз превышать равновесное расклинивающее давление, что и объясняет неоднозначное влияние межфазового поверхностного натяжения на агрегативную устойчивость эмульсий.
Лиофобные эмульсии нуждаются в повышении их агрегативной устойчивости, чего можно достигнуть введением веществ, называемых эмульгаторами и способных стабилизировать эмульсии.
Эмульгаторы порой определяют не только устойчивость, но и тип эмульсии. В зависимости от взаимодействия с жидкой фазой эмульгаторы могут быть гидрофобные и гидрофильные.
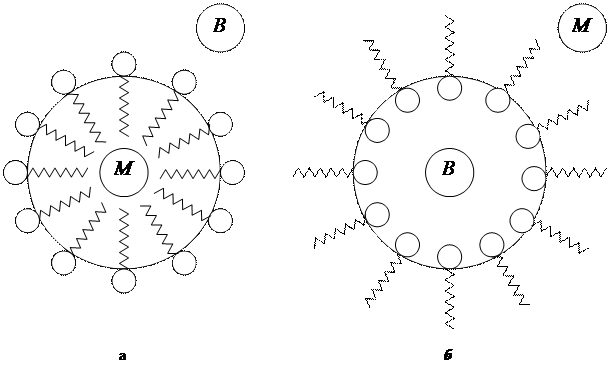
Наиболее распространенными гидрофильными эмульгаторами являются ПАВ. Такие ПАВ, как натриевые соли жирных кислот и аналогичную соли других щелочных металлов лучше растворяются в воде, чем в углеводородах. Они способны стабилизировать прямую эмульсию типа М/В (рис. 15.2, а). Полярные радикалы образующегося на границе раздела фаз адсорбционного слоя ПАВ находятся на наружной стороне капель масла, препятствуя тем самым их сближению. Эти же вещества в эмульсиях обратного типа В/М адсорбируются на внутренней поверхности капель воды (см. рис. 15,2, б), а образующийся адсорбционный слой является слабым препятствием для слипания капель. Поэтому стабилизация обратных эмульсий производится при помощи ПАВ, которые лучше растворяются в масле, чем в воде.
Ориентация адсорбционного слоя ПАВ происходит в соответствии с правилом уравнивания полярности Ребиндера (см. рис. 6.4): полярная группа молекул ПАВ обращена к полярной жидкости, а неполярный радикал — к неполярной. В связи с этим для прямой эмульсии (см. рис. 15.2, а) полярная часть молекул ПАВ будет обрамлять наружную поверхность капли, а в случае обратной эмульсии (см. рис. 15.2, б) — ее внутреннюю поверхность.
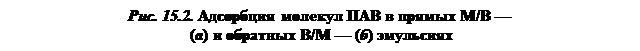
Эффективность эмульгатора можно характеризовать соотношением между гидрофильной и гидрофобной частями молекул ПАВ. Гидрофильные свойства определяются взаимодействием полярных групп молекул ПАВ с водой. Гидрофобный радикал молекул ПАВ обусловливает лиофильное взаимодействие между неполярной цепью молекул ПАВ и маслом. Лиофильное взаимодействие радикала ПАВ и масла будет гидрофобным по отношению к воде. Иными словами, в этих условиях радикал ПАВ хорошо взаимодействует с маслом и плохо — с водой.
Поверхностная активность определяется соотношением между гидрофильной и гидрофобной частями молекул ПАВ, Для короткоцепочечных ПАВ (рис. 15.3, а) преобладает гидрофильное взаимодействие, в результате которого молекулы втягиваются в воду. Противоположный эффект обнаруживается в случае длинноцепочечных молекул ПАВ. Гидрофобное взаимодействие по отношению к воде и лиофильное — к маслу обусловливают нахождение этих молекул в масле (см. рис. 15.3, б). Уравновешивание гидрофильного и лиофильного взаимодействий, так называемый гидрофильно-липофильный баланс (ГЛБ), т.е. определенное оптимальное соотношение действия воды и масла на молекулы ПАВ, определяет условия образования адсорбционного слоя на границе раздела двух жидкостей (см. рис. 15.3, в).
Гидрофильно-липофильный баланс является эмпирической безразмерной величиной
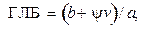 (15.5)
(15.5)
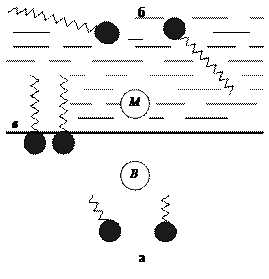 где b — безразмерный параметр, зависящий от природы ПАВ; ψ — свободная энергия взаимодействия в расчете на одну –СН2– группу; v — число групп –СH2– в углеводородном радикале (групповое число); а — сродство полярной группы молекулы ПАВ к воде.
где b — безразмерный параметр, зависящий от природы ПАВ; ψ — свободная энергия взаимодействия в расчете на одну –СН2– группу; v — число групп –СH2– в углеводородном радикале (групповое число); а — сродство полярной группы молекулы ПАВ к воде.
Величина (b + ψv) характеризует сродство (свободную энергию взаимодействия) неполярных групп молекул ПАВ к углеводородной жидкости.
 Число ГЛБ — есть отношение работы адсорбции молекул ПАВ на границе М-В из фазы масло [числитель формулы (15.5)] к работе адсорбции из водной фазы (знаменатель этой формулы). По значению ГЛБ определяют групповое число (число групп –СН2–) в углеводородном радикале молекулы ПАВ, обусловливающее адсорбцию ПАВ на границе М—В (рис. 15.З, в). Максимальная эмульгирующая способность зависит от свойств полярной гидрофильной части молекулы ПАВ и для мыла (стеаратов, олеатов и др.) она реализуется, когда групповое число составляет 12—18.
Число ГЛБ — есть отношение работы адсорбции молекул ПАВ на границе М-В из фазы масло [числитель формулы (15.5)] к работе адсорбции из водной фазы (знаменатель этой формулы). По значению ГЛБ определяют групповое число (число групп –СН2–) в углеводородном радикале молекулы ПАВ, обусловливающее адсорбцию ПАВ на границе М—В (рис. 15.З, в). Максимальная эмульгирующая способность зависит от свойств полярной гидрофильной части молекулы ПАВ и для мыла (стеаратов, олеатов и др.) она реализуется, когда групповое число составляет 12—18.
Адсорбционные слои ПАВ на границе раздела жидких фаз являются одним из факторов устойчивости эмульсий. Между углеводородными определенно ориентированными радикалами молекул ПАВ в адсорбционном слое возникают гидрофобные взаимодействия (см. параграф 5.5). Эти взаимодействия способствуют устойчивости эмульсий. Кроме того, адсорбционные слои ПАВ могут изменять межфазовое поверхностное натяжение, образовывать структуры и формировать структурно-механический барьер (см. параграф 10.8). Все эти факторы в совокупности могут препятствовать сближению капель и способствовать сохранению агрегативной устойчивости эмульсий.
Таким образом, действие адсорбционных слоев ПАВ, экранирующих границу раздела фаз эмульсий, неоднозначно и зависит от свойств ПАВ и жидкостей, образующих эмульсию.
Роль эмульгаторов могут выполнять измельченные порошки, размер частиц которых меньше капелек эмульсии. Действие твердых эмульгаторов основано на избирательном смачивании частиц порошков водой и маслом. Гидрофильные порошки (глина, бентонит, каолин, некоторые оксиды, карбонаты и сульфаты) лучше смачиваются водой и закрепляются со стороны водной фазы. Защитный слой таких частиц у прямой эмульсии образуется со стороны дисперсионной среды (рис. 15.4, а), а у обратной — со стороны дисперсной фазы (см. рис. 15.4, б). Положение гидрофобных частиц, которые не смачиваются водой, а смачиваются маслом, обратное тому, которое показано на рис. 15.4, — они обрамляют поверхность масла. В прямых эмульсиях слой частиц находится в дисперсной фазе, а в обратных — в дисперсионной среде. Гидрофобными порошкообразными эмульгаторами являются сажа, сульфиды тяжелых металлов (PbS, MoS2 и др.), твердые, богатые углеродом части битумов и сырой нефти.
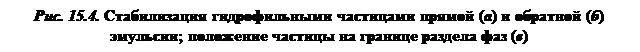
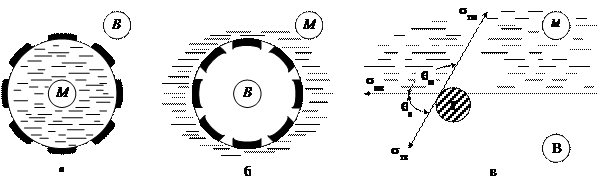 Действие порошков эмульгаторов обеспечивается особым положением частиц на границе раздела двух жидких фаз. Это положение в отношении гидрофильной сферической частицы, погруженной в воду, показано на рис. 15.4, в. Для гидрофильной поверхности частицы краевой угол по отношению к воде θв меньше краевого угла по отношению к маслу θм, т.е. θв < θм. Большая часть частицы будет находиться в объеме той жидкости, которая смачивает ее поверхность. Поэтому гидрофильная частица будет находиться преимущественно в водной среде. Краевые углы, которые образуются в результате нахождения частиц на границе раздела вода — масло, определяют положение этих частиц на поверхности раздела фаз.
Действие порошков эмульгаторов обеспечивается особым положением частиц на границе раздела двух жидких фаз. Это положение в отношении гидрофильной сферической частицы, погруженной в воду, показано на рис. 15.4, в. Для гидрофильной поверхности частицы краевой угол по отношению к воде θв меньше краевого угла по отношению к маслу θм, т.е. θв < θм. Большая часть частицы будет находиться в объеме той жидкости, которая смачивает ее поверхность. Поэтому гидрофильная частица будет находиться преимущественно в водной среде. Краевые углы, которые образуются в результате нахождения частиц на границе раздела вода — масло, определяют положение этих частиц на поверхности раздела фаз.
Устойчивое положение частиц на границе между водой и маслом и экранировка капелек дисперсной фазы противодействует коагуляции и коалесценции и обеспечивает устойчивость эмульсии.
Эмульсии все же менее устойчивы, чем золи. Они могут жить сутками и месяцами, но не десятки лет.
Дата добавления: 2018-11-24; просмотров: 1201; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
