От каких факторов зависит значение рН буферных растворов?
Основные положения протолитической теории.
Кислотой называют любую частицу, которая выделяет в р-р Н+.
Основаниями называют любую частицу, способную присоединять к себе Н+.
Три типа кислот по этой теории:
1. Нейтральные кислоты
СН3СООН = СН3СОО-+Н+
НСl = Н++Cl-
H2SO4 = H++HSO4-
2. Анионные кислоты
HSO4- = H++SO4-
H2PO4 = H++HPO4-
3. Катионные кислоты
NH4+ = H++NH3
CH3-NH3+ = H++CH3-NH2
H3O+=H++H2O
Три типа оснований
1. Нейтральное основание
NH3+H+ = NH4
CH3-NH2 + H+ = CH3-NH3+
H2O + H+ = H*H2O (H3O)
2. Анионные основания
CH3COO- + H+ = CH3COOH
HCO3- + H+ = H2CO3
3. Катионные основания
H3N-NH2+ + H+ = H3N+-NH3+
Кислота и основание проявляют свои свойства только в присутствии друг друга. Кислота, отдавая H+, превращается в сопряженное с ней основание
CH3COOH=CH3COO-+H+
NH3+H+=NH4+
По этой теории вода является амфотерным веществом, т.к. может проявлять свойства воды и основания.
СH3COOH+H2O=CH3COO-+H+*H20
Эта теория расширяет понятия кислот и оснований. По этой теории амины гетероцикличны. Катионы аминов и гетероциклов могут быть основаниями и кислотами.
В некоторых представлениях совпадает с т. диссоциации, особенно нейтральным кислотам и нейтральным основаниям
CH3COOH+NH3=CH3COO-+NH4+
2. Виды кислотности. Какого вида кислотности не имеют сильные кислоты?
Три основные вида кислотности в живых системах
1. Активная к-ть, которая создаётся конц H+ в р-ре.
Активную кислотность создают сильные кислоты
HCl = H++Cl- a=95%
2. Потенциальна к-ть (резервная к-ть), которая создается теми кат Н+, которая
|
|
|
остается слабых кислот или сильных анионов в не диссоциируемом состоянии
CH3COOH=CH3COO-+H+
H2PO4-=H++HPO42-
3. Общая кислотность складывается из суммы активной и потенциальной кислотности.
Буферные растворы, классификация, состав и свойства.
Это система, при добавлении к которым небольшого кол-ва сильной к-ты или щёлочи или при разбавлении Н2О рН не меняется.
1. Кислотные (слабая кислота и её анион А-/НА)
Состоят из слабой к-ты и её соли, образованной сильным основанием.
CH3COOH, CH3COONa, H2CO3, NaHCO3
Например, ацетатная БС CH3COO-/CH3COOH в растворе CH3COONa и CH3COOH, область действия – интервал рН 3,8-5,8. Водород-карбонатная сиcтема HCO3-/H2CO3 в растворе NaHCO3 и H2CO3, область её действия -рН 5,4-7,4.
2. Основные (Слабое основание и его катион В/ВН+)
Состоят из слабого основания и его соли, образованной сильной кислотой .
NH4OH, NH4Cl
Например, аммиачная БС NH3/NH4- в растворе NH3 и NH4Cl, область её действия -рН 8,2-10,2
3. Солевые (Анионы кислой и средней соли или двух кислых солей)
Состоят из 2-ух солей: а) кислой и нейтральной соли слабой к-ты , образованной сильным основанием Na2CO3, NaHCO3 (область её действия рН 9,3-11,3)
б) из 2-ух кислых солей слабой к-ты, образованной сильным основанием Na2HPO4, NaH2PO4 (область её действия 6,2-8,2)
|
|
|
4. Амфолитные (ионы и молекулы омфалитов)
Состоят из молекул АК, пептидов, белков. Если Ак или белки находятся в изоэлектрическом состоянии (суммарный заряд молекулы равен нуля), то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое кол-во кислоты или щёлочи. Тогда часть белка (аминокислоты) переходит из изоэлектрического состояния в форму «белок-кислота» или соответственно в форму «белок-основание». При этом образуется смесь двух форм белка:
А) слабая «белок-основание» + соль этой слабой кислоты
Б) слабое «белок-основание» + соль этого слабого основания
Вывод уравнения Гендерсона-Гассельбальха для кислотных и основных БС.
Потенциальная кислотность может увеличиваться при добавлении кислоты к буферному раствору и уменьшаться при добавлении основания, а активная кислотность при этом изменяется незначительно.
рН кислотного буферного р-ра можно определить по уравнению Гендерсона-Гассельбальха:
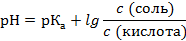
или
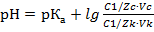
А основного буферного раствора по уравнению:
|
|
|
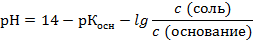
или
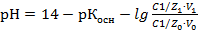
От каких факторов зависит значение рН буферных растворов?
На величину рН и рОН влияют константа диссоциации и соотношения концентраций компонентов. Разбавление буферного раствора не влияет на рН, т.к. при разбавлении в одинаковой степени меняется концентрация кислоты и соли, а их соотношение остаётся неизменным.
Дата добавления: 2018-11-24; просмотров: 7205; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
