Свойства углеводородных газов
Природные углеводородные газы представляют собой смесь предельных углеводородов, химическая формула которых имеет вид  . Обычно основным компонентом является метан
. Обычно основным компонентом является метан 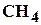 , его содержание достигает до 98%. Наряду с метаном в состав природных газов входят более тяжелые углеводороды: этан
, его содержание достигает до 98%. Наряду с метаном в состав природных газов входят более тяжелые углеводороды: этан 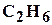 , пропан
, пропан 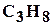 , бутан
, бутан 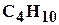 , пентан
, пентан 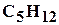 и другие, а также не углеводородные компоненты: азот
и другие, а также не углеводородные компоненты: азот 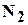 , двуокись углерода
, двуокись углерода 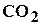 , сероводород
, сероводород 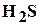 , гелий
, гелий 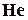 , аргон
, аргон 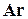 . Компонентный состав газов выражают в процентах или долях единицы по объему. Знание компонентного состава необходимо при определении физических свойств газов расчетными методами. Основные свойства компонентов природные газов приведены ниже в табл. 1.2:
. Компонентный состав газов выражают в процентах или долях единицы по объему. Знание компонентного состава необходимо при определении физических свойств газов расчетными методами. Основные свойства компонентов природные газов приведены ниже в табл. 1.2:
Таблица 1.2
Основные свойства компонентов природных газов
| Параметры | Обозна чение | СН4 | С2Нб | С3Н10 | IC4H10 | nС4Н10 | iC4H12 | nC5H12 | С6Н14 | C7H16 | N2 | CO2 | H2S |
| Молярная масса | М | 16,4 | 30,07 | 44,10 | 58,12 | 58.12 | 72,15 | 72,15 | 86,17 | 100,2 | 28,0 | 44,01 | 34,02 |
| Объем 1кг газа, м3 | 22,4 М | 1,4 | 0,74 | 0,508 | 0,385 | 0,385 | 0,31 | 0,31 | 0.262 | 0,223 | 0,70 | 0,509 | 0,658 |
| Плотность по воздуху | М 28,97 | 0,554 | 1,038 | 1,522 | 2,006 | 2,006 | 2,49 | 2,49 | 2.974 | 3,459 | 0,95 | 1,514 | 1,173 |
| Масса 1м3 газа, кг. | М 22,4 | 0,714 | 1,35 | 1,97 | 2,85 | 2.85 | 3,22 | 3,22 | 3,81 | 4,48 | 1,25 | 1,564 | 1,517 |
| Критическое Р, МПа | Ркр | 4,58 | 4,86 | 4,34 | 3.82 | 3,57 | 3,28 | 3,30 | 2,96 | 2,70 | 3,46 | 7,50 | 8,89 |
| Критическая Т, К° | Ткр | 191 | 305 | 370 | 407 | 425 | 461 | 470 | 508 | 540 | 125 | 304 | 373 |
|
|
|
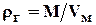 , (1.12)
, (1.12)
где:  - объем 1 моля (24,05)газа при стандартных условиях, м3.
- объем 1 моля (24,05)газа при стандартных условиях, м3.
Таблица 1.3
Растворимость метана в воде в зависимости от давления и
температуры. м3 / м3:
| Давление, МПа | Температура °С | |||||
| 60 | 100 | 150 | 200 | 250 | 300 | |
| 5 | 0,9 | 0,8 | 1 | 1,2 | - | - |
| 10 | 1,7 | 1,5 | 1,9 | 2,7 | 3,2 | 1,5 |
| 15 | 2,2 | 2,1 | 2,9 | 4,4 | 5,7 | 7,5 |
| 20 | 2,7 | 2,7 | 3,7 | 5,7 | 8,2 | 13,0 |
| 25 | 3,1 | 3,1 | 4,2 | 7,1 | 10,6 | 18,4 |
| 30 | 3,4 | 3,5 | 4,7 | 8,1 | 12,0 | 13,1 |
| 40 | 4,1 | 4,2 | 5,9 | 10,1 | 16,6 | 31,6 |
| 50 | 4,5 | 4,7 | 6,7 | 11,1 | 19,7 | 38,1 |
| 60 | 5,0 | 5.2 | 7,5 | 12,4 | 22,1 | 43,2 |
| 80 | - | - | 9,0 | 15,0 | 26,4 | 52,4 |
| 100 | - | - | 10,0 | 16,6 | 29,5 | 59,0 |
Вязкость природных газов - свойство оказывать сопротивление перемещению одной их части относительно другой. Она зависит от состава газа, давления и температуры.
Растворимость. Углеводороды растворяются в воде незначительно. При низких давлениях и температуре с увеличением последней растворимость падает. Начиная с 70°С и выше, и давлении более 10 МПа повышение температуры приводит к увеличению растворимости газа
Газосодержание (газонасыщенность), пластовых жидкостей показывает объемное количество растворенного газа 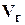 (измеренного в стандартных условиях) содержащегося в единице объема пластовой воды
(измеренного в стандартных условиях) содержащегося в единице объема пластовой воды 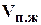 :
:
|
|
|
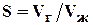 (1.13)
(1.13)
Газосодержание обычно выражают м3 / м3 , или см3 / л.
Уравнение состояния газов
Состояние идеальных газов в условиях высоких давлений и температуры определяется уравнением Клапейрона - Менделеева:
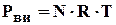 (1.14)
(1.14)
где: Р - давление, МПа;
Т - температура, К;
N - число киломолей газа;
R - универсальная постоянная.
Реальные углеводородные газы отклоняются от законов идеального газа, и уравнение Клапейрона-Менделеева для реальных газов записывается в виде:
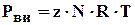 (1.15)
(1.15)
z - коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа.
Коэффициент сверхсжимаемости реальных газов - это отношение объемов равного числа молей реального и идеального газов при одинаковых термобарических условиях:
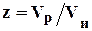 (1.16)
(1.16)
Объемный коэффициент пластового давления газа, представляющий собой отношение объема газа, 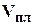 , который он занимает в пластовых условиях к объему
, который он занимает в пластовых условиях к объему 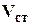 , который он занимает в стандартных условиях.
, который он занимает в стандартных условиях.
|
|
|
Взрываемость. Природный газ при соединении с кислородом и воздухом отличается повышенной взрываемостью. Пределы взрываемости метана в воздухе составляют при его объемной доле 5,35-14,9%. Сероводород заметно расширяет взрываемость природного газа.
Дата добавления: 2018-11-24; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
